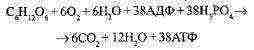MÉTHODES DE CULTURE DE MICRO-ORGANISMES. ÉTUDE DE CULTURE ET BIOCHIMIE
PROPRIÉTÉS
La culture, c'est-à-dire la culture de micro-organismes en laboratoire, permet d'étudier leurs propriétés et d'obtenir de la biomasse. Les bactéries, les champignons, les actinomycètes, les spirochètes et certains protozoaires sont cultivés sur des milieux nutritifs. Chlamydia, rickettsia, virus et certains protozoaires ne peuvent se reproduire que dans le corps d'un animal ou dans des cellules vivantes.
Les propriétés culturelles de ce type de micro-organismes sont : 1) les conditions nécessaires à la reproduction, et 2) la nature de la croissance sur les milieux nutritifs. Les biens culturels sont l'une des caractéristiques qui sont prises en compte lors de l'identification (détermination du type) de micro-organismes.
Média culturel
Les milieux de culture doivent répondre à certaines exigences. Ils doivent contenir tous les nutriments nécessaires à la reproduction de ce type de microbes. Certains micro-organismes pathogènes se développent sur des milieux nutritifs simples, tandis que d'autres ont besoin d'un apport de sang, de sérum sanguin et de vitamines pour leur reproduction.
Dans les milieux de culture, certaines conditions doivent être créées en ajoutant du chlorure de sodium ou des solutions tampons. Pour la plupart des bactéries, un milieu nutritif contenant 0,5% de chlorure de sodium est favorable. La réaction du milieu nutritif, favorable à la plupart des bactéries pathogènes, est légèrement alcaline, ce qui correspond à pH = 7,2-7,4. Vibrio cholerae pousse à pH = 7,8-8,5, les champignons - à pH = 5-5,5. Les milieux de culture doivent être humides, c'est-à-dire contenir une quantité d'eau suffisante, être aussi transparents et stériles que possible, c'est-à-dire, avant le semis, ne pas contenir de microbes.
En termes de composition et d'origine, les milieux nutritifs sont naturels, artificiels et synthétiques. Les milieux de culture naturels sont des produits naturels tels que les pommes de terre et autres légumes. Les milieux nutritifs artificiels sont préparés selon une recette spécifique à partir de produits additionnés de composés organiques et inorganiques. Les supports synthétiques contiennent certains composés chimiques à des concentrations connues.
Par consistance, les milieux nutritifs sont liquides, semi-liquides, denses. L'agar-agar-polysaccharide isolé des algues est généralement utilisé comme scellant. L'agar-agar n'est pas utilisé par les micro-organismes comme nutriment ; il forme un gel dans l'eau qui fond à 100°C et se solidifie à 45°C.
Pour obtenir un milieu nutritif dense, de l'agar-agar est ajouté à une concentration de 1,5 à 2%, pour le semi-liquide à 0,5%.
Selon leur destination, les milieux de culture peuvent être divisés en diagnostics ordinaires (simples), spéciaux, électifs et différentiels.
Les milieux nutritifs conventionnels (simples) sont utilisés pour la culture de la plupart des micro-organismes, il s'agit du bouillon mésopatamique (MPB), de la gélose mésopatamique (MPA).
Des milieux nutritifs spéciaux sont utilisés pour la culture de micro-organismes qui ne poussent pas sur des milieux simples. Par exemple, gélose au sang et bouillon de sucre pour le streptocoque, gélose au sérum pour le méningocoque et le gonocoque.
Les milieux de culture électifs sont utilisés pour isoler une espèce d'un mélange de différentes bactéries. Ce type de bactéries se développe sur cet environnement plus rapidement et mieux que d'autres, les dépassant dans sa croissance ; la croissance d'autres bactéries est retardée sur ce milieu. Par exemple, le sérum coagulé pour le bacille diphtérique, l'eau peptonée alcaline pour le vibrion cholérique, le bouillon biliaire pour le bacille typhoïde, les milieux salins pour le staphylocoque.
Les milieux de culture de diagnostic différentiel permettent de distinguer certains types de bactéries des autres par leur activité enzymatique (voir la rubrique correspondante).
Culture et isolement de cultures pures de bactéries aérobies
Pour la culture de micro-organismes, certaines conditions sont nécessaires : température, conditions aérobies ou anaérobies.
La température doit être optimale pour l'espèce. La plupart des bactéries pathogènes se développent à 37°C. Cependant, pour certaines espèces, une température plus basse est optimale, ce qui est associé aux particularités de leur écologie. Ainsi, pour le bacille de la peste, dont l'habitat naturel est le rongeur pendant l'hibernation, la température optimale est de 28°C, ainsi que pour le leptospira, pour le bacille du botulisme - 28°C-35°C.
En plus de la température optimale, pour la culture des micro-organismes, selon les espèces, un environnement aérobie ou anaérobie est requis.
Afin d'étudier la morphologie, les propriétés culturelles, biochimiques et autres des microbes, il est nécessaire d'obtenir une culture pure. Habituellement, une culture de microbes est appelée leur accumulation sur un milieu nutritif sous forme de turbidité, de croissance près du fond (paroi) ou d'un film à la surface d'un milieu liquide ou de colonies sur un milieu dense. Une seule colonie est formée à partir d'une cellule microbienne. Une culture pure est une culture de microbes de la même espèce obtenue à partir d'une seule colonie. Dans les laboratoires, certaines souches connues de microbes sont utilisées pour diverses études. Une souche est une culture pure de microbes obtenus à partir d'une source spécifique, à un moment précis, avec des propriétés connues. Typiquement, les souches microbiennes sont désignées par un numéro spécifique. Par exemple, la souche Staphylococcus aureus 209P est utilisée pour déterminer l'activité de la pénicilline.
L'isolement de cultures pures d'aérobies prend généralement trois jours et s'effectue selon le schéma suivant :
1er jour - microscopie d'un frottis du matériel de test, coloré (généralement par Gram) - pour une connaissance préliminaire de la microflore, qui peut être utile pour choisir un milieu de culture pour l'inoculation. Puis ensemencement du matériel sur la surface de la gélose nutritive congelée pour obtenir des colonies isolées. Le tamisage peut être effectué selon la méthode Drygalsky dans trois boîtes de Pétri avec un milieu nutritif. Une goutte de matière est appliquée sur le premier gobelet et étalée sur l'ensemble du gobelet à l'aide d'une spatule. Ensuite, avec la même spatule, répartissez le reste de culture dessus sur la deuxième tasse et de la même manière sur la troisième. Le plus grand nombre de colonies se développera sur la première plaque, le moins sur la troisième. Des colonies isolées se développeront sur l'une des plaques, en fonction du nombre de cellules microbiennes présentes dans le matériel d'essai.
Le même résultat peut être obtenu en tamisant sur une tasse. Pour ce faire, divisez la tasse en quatre secteurs. Le matériel à l'étude est ensemencé avec une anse bactériologique avec des coups sur le premier secteur, puis, après avoir calciné et refroidi l'anse, l'inoculation est répartie du premier secteur au deuxième et de la même manière séquentiellement dans les troisième et quatrième secteurs. Des colonies isolées sont formées à partir de cellules microbiennes individuelles après une incubation quotidienne dans un thermostat.
2ème jour - étude des colonies cultivées sur plaques, description de celles-ci. Les colonies peuvent être transparentes, translucides ou opaques, elles ont des tailles différentes, des contours arrondis réguliers ou irréguliers, une forme convexe ou plate, une surface lisse ou rugueuse, lisse ou ondulée, des bords déchiquetés. Ils peuvent être incolores ou blancs, dorés, rouges, jaunes. Sur la base de l'étude de ces caractéristiques, les colonies cultivées sont divisées en groupes. Ensuite, une colonie isolée est sélectionnée dans le groupe d'étude, un frottis est préparé pour un examen microscopique afin de vérifier l'homogénéité des microbes dans la colonie. La même colonie est inoculée dans un tube à essai avec une gélose nutritive inclinée.
3ème jour - vérification de la pureté de la culture cultivée sur gélose inclinée par microscopie de frottis. Avec l'homogénéité des bactéries étudiées, l'isolement d'une culture pure peut être considéré comme complet.
Pour identifier les bactéries isolées, des traits culturels sont étudiés, c'est-à-dire la nature de la croissance sur des milieux nutritifs liquides et solides. Par exemple, les streptocoques sur bouillon de sucre forment un sédiment de fond et pariétal, sur gélose au sang - petites colonies ponctuelles; le vibrion cholérique forme un film à la surface de l'eau peptonée alcaline et des colonies transparentes sur la gélose alcaline ; le bacille de la peste sur gélose nutritive forme des colonies sous forme de "mouchoirs en dentelle" avec un centre dense et des bords ondulés minces, et dans un milieu nutritif liquide - un film à la surface, puis - des fils s'étendant de celui-ci sous la forme de " stalactites".
Culture et isolement de cultures pures de bactéries anaérobies
Pour la culture des anaérobies, il est nécessaire d'abaisser le potentiel d'oxydo-réduction du milieu, de créer une anaérobiose en éliminant l'oxygène par des méthodes physiques, chimiques ou biologiques.
Les méthodes physiques comprennent :
1) élimination mécanique de l'air au moyen d'une pompe de l'anae-rostat, dans laquelle des boîtes avec des inoculations sont placées. En même temps, vous pouvez remplacer l'air par un gaz indifférent : azote, hydrogène, dioxyde de carbone.
2) croissance dans un milieu contenant des substances réductrices. Kitta-Tarozzi mercredi est un bouillon de sucre avec des morceaux de foie ou de viande. Le glucose et les morceaux d'organes ont une capacité réductrice. Le milieu est versé sur le dessus avec une couche d'huile de vaseline pour bloquer l'accès de l'oxygène de l'air.
3) La méthode la plus simple, mais la moins fiable, consiste à cultiver profondément dans une haute colonne de gélose au sucre.
Les méthodes chimiques consistent dans le fait que des plats contenant des cultures d'anaérobies sont placés dans un dessiccateur hermétiquement fermé, où sont placés des produits chimiques, par exemple du pyrogallol et des alcalis, dont la réaction se déroule avec l'absorption d'oxygène.
La méthode biologique est basée sur la culture simultanée d'anaérobies et d'aérobies sur des milieux nutritifs solides dans des boîtes de Pétri, hermétiquement scellées après inoculation. Tout d'abord, l'oxygène est absorbé par les aérobies en croissance, puis la croissance des anaérobies commence.
L'isolement d'une culture pure d'anaérobies commence par l'accumulation de bactéries anaérobies par inoculation sur milieu Kitta-Tarozzi. À l'avenir, les colonies isolées sont obtenues de l'une des deux manières suivantes :
1) le matériel est ensemencé par mélange avec de la gélose au sucre chaud fondu dans des tubes en verre. Après solidification de la gélose, des colonies isolées se développent dans ses profondeurs, qui sont prélevées en coupant le tube et repiquées sur milieu Kitt-Tarozzi (méthode de Weinberg) ;
2) l'ensemencement du matériel est réalisé sur des plaques avec un milieu nutritif et incubé en anaérostat. Les colonies isolées cultivées sur plaque sont repiquées sur milieu Kitt-Tarozzi (méthode Zeissler).
Culture d'autres micro-organismes
Culture de mycoplasmes
Les mycoplasmes sont cultivés sur des milieux nutritifs additionnés de sérum et de glucides. Comme les mycoplasmes n'ont pas de paroi cellulaire, ils ne se développent que dans des environnements isotoniques ou hypertoniques. Sur des milieux nutritifs solides, pendant plusieurs jours, de très petites colonies se forment, ressemblant à des œufs au plat - avec un centre convexe et une périphérie plate translucide. Les mycoplasmes peuvent également être cultivés dans des embryons de poulet ou en culture cellulaire.
Culture de rickettsia et de chlamydia
Les rickettsies et les chlamydiaes sont des parasites intracellulaires obligatoires. Pour leur culture, des cultures cellulaires, des embryons de poulet et des infections animales sont utilisés.
Culture de champignons
Pour la culture des champignons, des milieux nutritifs denses et liquides sont utilisés : le plus souvent le milieu de Sabouraud, ainsi que les milieux contenant du moût de bière. Les champignons poussent plus lentement que les bactéries, ils forment une croissance visible en quelques jours. La température de culture est inférieure à celle des bactéries - 22-30 ° C.
Culture de spirochètes et de protozoaires
Parmi les spirochètes, il est le plus facile de cultiver des leptospira, pour lesquels l'eau mélangée à du sérum sanguin de lapin peut servir de milieu nutritif.Borrelia et Treponema sont cultivés dans des conditions anaérobies sur des milieux nutritifs plus complexes contenant du sérum, des morceaux de tissus animaux.
Parmi les protozoaires, la dysenterie amibe, lamblia, Trichomonas, leishmania, trypanosome, balantidia sont cultivés sur des milieux nutritifs.Toxoplasma est cultivé sur des embryons de poulet et des cultures tissulaires. Des méthodes de culture des plasmodes du paludisme sont en cours de développement.
Méthodes d'étude de l'activité enzymatique (propriétés biochimiques)
Dans la pratique microbiologique, l'étude de l'activité enzymatique est utilisée pour identifier les micro-organismes, car chaque espèce microbienne possède un certain ensemble d'enzymes.
Pour déterminer l'activité protéolytique, les microbes sont inoculés avec une injection dans une colonne de gélatine, et après 3-5 jours d'incubation à température ambiante, le caractère de liquéfaction de la gélatine est noté : sous forme d'entonnoir, d'ongle, de bas ou sous la forme d'un sapin de Noël renversé. L'activité protéolytique est également déterminée par la formation de produits de décomposition de protéines : indole, sulfure d'hydrogène, ammoniac. Pour les déterminer, des micro-organismes sont ensemencés dans un bouillon de viande-peptone, et des papiers indicateurs sont placés entre le col du tube à essai et un bouchon en coton, en excluant leur contact avec le milieu. Lorsque l'indole se forme, le papier imprégné d'une solution saturée d'acide oxalique devient rose ; en présence d'hydrogène sulfuré, le papier imprégné d'acétate de plomb noircit ; lorsque l'ammoniac se forme, le papier de tournesol rouge devient bleu.
Pour déterminer les propriétés saccharolytiques des microbes, des milieux de diagnostic différentiel sont utilisés, tels que le milieu de Giss, le milieu d'Olkénitsky, le milieu d'Endo, le milieu de Levin, le milieu de Ploskirev.
Les médias Endo, Levin, Ploskirev dans les boîtes de Pétri sont utilisés pour différencier les bactéries du groupe intestinal par leur capacité à fermenter le lactose. Ces milieux contiennent de la gélose nutritive, du lactose et un indicateur qui change de couleur dans un milieu acide - un indicateur de pH. Si des bactéries qui fermentent le lactose, telles que E. coli, sont semées dans un tel environnement, de l'acide se forme à la suite de la fermentation du lactose et l'indicateur changera de couleur dans un environnement acide. Ainsi, les colonies d'Escherichia coli sur ces milieux seront colorées selon la couleur de l'indicateur : sur milieu d'Endo et de Ploskirev - en rouge, sur milieu de Levin - en noir et bleu. Les colonies de bactéries qui ne fermentent pas le lactose, comme les bâtonnets de salmonelle et de dysenterie, seront incolores.
Les milieux Giss (milieu « panaché ») sont préparés à base d'eau peptonée ou de gélose viande-peptone semi-liquide. Contient un glucide ou un alcool polyhydrique et un indicateur. Lorsqu'un microbe se développe sur le milieu de Giss, fermentant ce substrat avec formation d'acide et de gaz, le milieu va changer de couleur, en milieu semi-liquide, des bulles et des ruptures apparaissent dans l'épaisseur de la gélose, en milieu liquide - un gaz bulle dans un flotteur en verre. Lorsque le substrat est fermenté uniquement en acide, il n'y a qu'un changement de couleur du milieu.
Des milieux combinés ne contenant pas un hydrate de carbone, mais deux ou trois sont également utilisés, par exemple le milieu d'Olkénitsky. Un tube de ce milieu remplace les milieux gélosés et Giss par du lactose, du glucose et du saccharose. Après stérilisation à l'état fondu, le milieu dans l'éprouvette est biseauté de manière à obtenir une colonne et une partie biseautée. Le semis se fait d'un trait le long de la partie biseautée et d'une piqûre dans une colonne. Lorsque le lactose ou le saccharose sont fermentés, la couleur de l'ensemble du milieu change ; lorsqu'un glucose est fermenté, seule la couleur de la colonne change. La formation de gaz est indiquée par la présence de bulles dans la colonne d'agar. Lorsque les microbes libèrent de l'ammoniac, la couleur du milieu ne change pas. La formation de sulfure d'hydrogène se manifeste par un noircissement dans la table de gélose
Pour la méthode express de détermination de l'activité enzymatique des bactéries, des systèmes de microtest et un système de papier indicateur (NIB) sont utilisés
Le système de microtest est un récipient en polystyrène transparent, composé de plusieurs cellules. Les cellules contiennent des milieux nutritifs séchés avec des glucides et des indicateurs de pH. Une suspension d'une culture de bactéries d'une certaine densité est inoculée dans chaque cellule. Une solution saline est versée dans les cellules de contrôle.
indicateur
Les systèmes de papier indicateur (NIB) pour l'identification de la famille des Enterobacteriaceae sont des disques ou des bandes de papier chromatographique, recouverts d'un film protecteur et contenant un substrat et un indicateur spécifiques Dans des tubes à essai avec une solution physiologique ou tampon, ajouter la culture d'essai, puis placer les disques Dans les tubes témoins, la culture de bactéries n'est pas ajoutée Le résultat est pris en compte en changeant la couleur de l'indicateur Pour doser l'hydrogène sulfuré, le disque est posé à la surface de l'AMP, ensemencé par une injection, ce qui permet de doser simultanément la mobilité
Dans tous les tubes, le résultat préliminaire du même jour et le résultat final du lendemain sont pris en compte.
L'activité oxydase est déterminée en frottant la culture sur un papier indicateur, le résultat est pris en compte au bout d'une minute.
Les micro-organismes (à l'exception des parasites intracellulaires obligatoires — rickettsies, chlamydia, virus et protozoaires) sont généralement cultivés sur des milieux nutritifs artificiels. Selon les besoins nutritionnels de l'un ou l'autre type de milieu nutritif doit contenir les substances de départ appropriées nécessaires au métabolisme plastique et énergétique.
L'isolement de micro-organismes à partir de divers matériaux et la production de leurs cultures sont largement utilisés dans la pratique de laboratoire pour le diagnostic microbiologique des maladies infectieuses, dans les travaux de recherche et dans la production microbiologique de vaccins, d'antibiotiques et d'autres produits biologiquement actifs de l'activité vitale microbienne.
Les conditions de culture dépendent également des propriétés des micro-organismes respectifs. La plupart des microbes pathogènes sont cultivés sur des milieux nutritifs à 37°C pendant 12 jours. Cependant, certains d'entre eux nécessitent des délais plus longs. Par exemple, les bactéries de la coqueluche - en 2-3 jours, et Mycobacterium tuberculosis - en 3-4 semaines.
Pour stimuler les processus de croissance et de reproduction des microbes aérobies, ainsi que pour réduire le temps de leur culture, la méthode de culture immergée est utilisée, qui consiste en une aération et une agitation continues du milieu nutritif. La méthode profonde a trouvé une large application en biotechnologie.
Pour la culture des anaérobies, des méthodes spéciales sont utilisées, dont l'essence est d'éliminer l'air ou de le remplacer par des gaz inertes dans des thermostats scellés - des anaérostats. Les anaérobies sont cultivés sur des milieux nutritifs contenant des substances réductrices (glucose, formiate de sodium, etc.) qui réduisent le potentiel redox.
Dans la pratique du diagnostic, les cultures pures de bactéries sont d'une importance particulière, qui sont isolées du matériel de test prélevé sur un patient ou des objets environnementaux. À cette fin, des milieux nutritifs artificiels sont utilisés, qui sont subdivisés en milieux de base, de diagnostic différentiel et électifs de la composition la plus diverse. Le choix d'un milieu nutritif pour l'isolement d'une culture pure est essentiel pour le diagnostic bactériologique.
Dans la plupart des cas, des milieux de culture solides sont utilisés, préalablement versés dans des boîtes de Pétri. Le matériel d'essai est placé sur la surface du milieu dans une boucle et trituré avec une spatule pour obtenir des colonies isolées cultivées à partir d'une cellule. La sous-culture d'une colonie isolée sur gélose inclinée dans un tube à essai donne une culture pure.
Pour l'identification, c'est-à-dire déterminant le générique et l'espèce appartenant à la culture sélectionnée, les caractères phénotypiques sont le plus souvent étudiés :
a) la morphologie des cellules bactériennes dans les frottis colorés ou les préparations natives ;
b) des signes biochimiques de culture selon sa capacité à fermenter les glucides (glucose, lactose, saccharose, maltose, mannitol, etc.), pour former de l'indole, de l'ammoniac et de l'hydrogène sulfuré, produits de l'activité protéolytique des bactéries.
Pour une analyse plus complète, la chromatographie gaz-liquide et d'autres méthodes sont utilisées.
Parallèlement aux méthodes bactériologiques pour l'identification des cultures pures, des méthodes de recherche immunologiques sont largement utilisées, qui visent à étudier la structure antigénique de la culture isolée. A cet effet, des réactions sérologiques sont utilisées : agglutination, précipitation par immunofluorescence, liaison au complément, dosage immuno-enzymatique, méthodes de dosage radio-immunologique, etc.
-
Méthodes pour isoler la culture pure
Afin d'isoler une culture pure de micro-organismes, il est nécessaire de séparer les nombreuses bactéries présentes dans le matériel, les unes des autres. Ceci peut être réalisé avec des méthodes basées sur deux principes -mécanique etbiologique dissociation des bactéries.
Méthodes d'isolement de cultures pures basées sur un principe mécanique
Méthode de dilution en série, proposé par L. Pasteur, a été l'un des tout premiers à être utilisé pour la séparation mécanique des micro-organismes. Elle consiste à effectuer des dilutions en série d'un matériau contenant des microbes dans unliquidemilieu nutritif. Cette technique est assez laborieuse et imparfaite dans son travail, car elle ne permet pas de contrôler le nombre de cellules microbiennes qui pénètrent dans les éprouvettes lors des dilutions.
Il n'a pas cet inconvénientMéthode Koch (méthode de dilution sur plaque). R. Koch a utilisé des milieux nutritifs solides à base de gélatine ou d'agar-agar. Le matériel avec des associations de différents types de bactéries a été dilué dans plusieurs tubes à essai avec de la gélatine fondue et légèrement refroidie, dont le contenu a ensuite été versé sur des plaques de verre stériles. Après gélification du milieu, celui-ci a été cultivé à la température optimale. Des colonies isolées de micro-organismes se sont formées dans son épaisseur, qui peuvent être facilement transférées dans un milieu nutritif frais à l'aide d'une boucle de platine pour obtenir une culture pure de bactéries.
La méthode de Drygalskiest une méthode plus avancée qui est largement utilisée dans la pratique microbiologique quotidienne. Tout d'abord, le matériau d'essai est appliqué à la surface du milieu dans une boîte de Pétri avec une pipette ou une boucle. À l'aide d'une spatule en métal ou en verre, frottez-la soigneusement dans le support. Le plat est maintenu ouvert pendant l'ensemencement et doucement tourné pour répartir le matériel uniformément. Sans stériliser la spatule, ils réalisent le matériel emprunté dans une autre boîte de Pétri, si nécessaire, dans une troisième. Ce n'est qu'alors que la spatule est plongée dans une solution désinfectante ou frite dans une flamme de brûleur. À la surface du milieu, dans la première boîte, on observe, en règle générale, une croissance continue des bactéries, dans la deuxième - croissance dense et dans la troisième - croissance sous forme de colonies isolées.
Colonies de Drigalski
Méthode de culture en ligneaujourd'hui, il est le plus souvent utilisé dans les laboratoires de microbiologie. Le matériel contenant des micro-organismes est collecté avec une boucle bactériologique et appliqué à la surface du milieu de culture près du bord de la boîte. Retirez l'excès de matériau et maintenez-le en mouvements parallèles d'un bord à l'autre de la tasse. Après une journée d'incubation des inoculations à la température optimale, des colonies isolées de microbes se développent à la surface de la boîte.
Méthode de course
Pour obtenir des colonies isolées, vous pouvez utiliser un écouvillon couvert, qui a été utilisé pour collecter le matériel de test. Ouvrez un peu la boîte de Pétri avec le milieu nutritif, insérez-y un tampon et frottez le matériau sur la surface de la boîte avec des mouvements prudents, en retournant progressivement le tampon et la boîte.
Ainsi, un avantage significatif des méthodes de Koch, Drygalsky et de culture en stries des dilutions sur plaque est qu'elles créent des colonies isolées de micro-organismes, qui, lorsqu'elles sont inoculées sur un autre milieu nutritif, se transforment en une culture pure.
Méthodes d'isolement de cultures pures basées sur un principe biologique
Le principe biologique de la séparation des bactéries permet une recherche ciblée de méthodes prenant en compte les nombreuses caractéristiques des cellules microbiennes. Parmi les méthodes les plus courantes figurent les suivantes :
1. Par le type de respiration. Tous les micro-organismes par type de respiration sont divisés en deux groupes principaux:aérobique (Corynebacterium diphtheriaeVibrio сholerae etc) etanaérobie (Clostridium tetaniClostridium botulinumClostridium perfringens et etc.)... Si le matériel à partir duquel les agents pathogènes anaérobies doivent être isolés est préchauffé puis cultivé dans des conditions anaérobies, alors ces bactéries se développeront.
2. Parsporulation. On sait que certains microbes (bacilles et clostridies) sont capables de fertilité. Parmi euxClostridium tetaniClostridium botulinumClostridium perfringensBacillus subtilisBacillus cereus... Les litiges résistent aux facteurs environnementaux. Par conséquent, le matériau d'essai peut être soumis à l'action d'un facteur thermique, puis transféré par inoculation dans le milieu nutritif. Après un certain temps, exactement les bactéries capables de fertilité se développeront dessus.
3. Résistance des microbes aux acides et aux alcalis. Certains germes(Mycobacterium tuberculosisMycobactérie bovis) en raison des particularités de leur structure chimique, ils sont résistants à l'action des acides. C'est pourquoi le matériel qui les contient, par exemple les expectorations de la tuberculose, est prétraité avec un volume égal de solution d'acide sulfurique à 10%, puis semé sur des milieux nutritifs. La flore étrangère meurt et les mycobactéries, en raison de leur résistance aux acides, se développent.
Vibrion cholérique(Vibrio сholerae)au contraire, c'est une bactérie halophile, donc, pour créer des conditions de croissance optimales, elle est semée sur des supports qui contiennent des alcalis (1% d'eau peptonée alcaline). En 4 à 6 heures, des signes caractéristiques de croissance apparaissent à la surface du milieu sous la forme d'un délicat film bleuté.
4. Mobilité des bactéries. Certains germes(Proteus vulgaris) ont tendance à ramper et sont capables de se répandre rapidement à la surface d'un environnement quelque peu humide. Pour isoler ces agents pathogènes, ils sont inoculés dans une goutte de liquide de condensation, qui se forme lorsque la gélose inclinée est refroidie. Après 16-18 ans, ils se sont propagés à toute la surface de l'environnement. Si nous prélevons du matériel du haut de la gélose, nous aurons une culture pure d'agents pathogènes.
5. La sensibilité des microbes à l'action des produits chimiques, antibiotiques et autres agents antimicrobiens.En raison des caractéristiques du métabolisme des bactéries, elles peuvent avoir une sensibilité différente à certains facteurs chimiques. On sait que les staphylocoques, bacilles aérobies qui forment des spores, sont résistants à l'action de 7,5 à 10 % de chlorure de sodium. C'est pourquoi pour l'isolement de ces agents pathogènes, des milieux nutritifs électifs (agar jaune-sel, gélose beckon-sel) sont utilisés, qui contiennent cette substance même. Les autres bactéries ne se développent pratiquement pas à cette concentration de chlorure de sodium.
6. Administration de certains antibiotiques(nystatine) est utilisé pour inhiber la croissance des champignons dans le matériel qui en est fortement contaminé. A l'inverse, l'ajout de l'antibiotique pénicilline au milieu favorise la croissance de la flore bactérienne si des champignons doivent être isolés. L'ajout de furazolidone à certaines concentrations au milieu nutritif crée des conditions sélectives pour la croissance des corynébactéries et des microcoques.
7. La capacité des micro-organismes à pénétrer à travers la peau intacte. Certaines bactéries pathogènes(Yersinia pestis) en raison de la présence d'un grand nombre d'enzymes d'agression, ils sont capables de pénétrer à travers la peau intacte. Pour cela, la laine sur le corps de l'animal de laboratoire est rasée et le matériau de test est frotté dans cette zone, qui contient l'agent pathogène et une grande quantité de microflore tierce. Après un certain temps, l'animal est abattu et des microbes sont libérés du sang ou des organes internes.
8. Sensibilité des animaux de laboratoire aux agents infectieux.Certains animaux sont très sensibles à divers micro-organismes.
Par exemple, avec n'importe quelle voie d'administrationStreptococcus pneumoniaeles souris blanches développent une infection pneumococcique généralisée. Une image similaire est observée lorsque les cobayes sont infectés par des agents pathogènes de la tuberculose.(Mycobacterium tuberculosis).
Dans la pratique quotidienne, les bactériologistes utilisent des concepts tels quesoucheetculture puremicro-organismes. Par souche, on entend des microbes de la même espèce, qui sont isolés de sources différentes, ou de la même source, mais à des moments différents. Une culture pure de bactéries est constituée de micro-organismes de la même espèce, descendants d'une cellule microbienne, qui se sont développés sur (dans) un milieu nutritif.
Isolement de la culture pure aérobie micro-organismes se compose de plusieurs étapes.
Premier jour(Étape 1 recherche) le matériel pathologique est introduit dans un récipient stérile (tube à essai, flacon, flacon). Ils l'étudient - apparence, texture, couleur, odeur et autres signes, préparent un frottis, le peignent et l'examinent au microscope. Dans certains cas (gonorrhée aiguë, peste), un diagnostic préalable peut être posé à ce stade, et en plus, il est possible de sélectionner le milieu sur lequel le matériel sera inoculé. Ensuite, ils réalisent une boucle bactériologique (le plus souvent utilisée), à l'aide d'une spatule - selon la méthode Drygalsky, avec un coton-tige. Les tasses sont fermées, retournées, signées avec un crayon spécial et placées dans un thermostat à une température optimale (37°C) pendant 18-48 heures. Le but de cette étape est d'obtenir des colonies isolées de microorganismes.
Cependant, parfois afin d'empiler le matériel, il est semé sur des milieux nutritifs liquides.
Le deuxième jour(Recherche de l'étape 2) à la surface d'un milieu nutritif dense, les micro-organismes forment une croissance continue et dense ou des colonies isolées.La colonie - Ce sont les accumulations de bactéries visibles à l'œil nu en surface ou dans l'épaisseur du milieu nutritif. En règle générale, chaque colonie est formée des descendants d'une cellule microbienne (clones), leur composition est donc assez homogène. Les caractéristiques de la croissance des bactéries sur les milieux nutritifs sont une manifestation de leurs propriétés culturelles.
Les plaques sont scrutées et examinées à la recherche de colonies isolées qui se sont développées à la surface de la gélose. Faites attention à la taille, la forme, la couleur, la nature des bords et la surface des colonies, leur consistance et d'autres caractéristiques. Si nécessaire, examinez les colonies à la loupe, faible ou fort grossissement du microscope. La structure des colonies est examinée en lumière transmise à faible grossissement du microscope. Elles peuvent être hyalines, granuleuses, filamenteuses ou fibreuses, qui se caractérisent par la présence de fils entrelacés dans l'épaisseur des colonies.
La caractérisation des colonies est une partie importante du travail d'un bactériologiste et d'un assistant de laboratoire, car les micro-organismes de chaque espèce ont leurs propres colonies spéciales.
Le troisième jour(Étape 3) recherche) étudier la nature de la croissance d'une culture pure de micro-organismes et procéder à son identification.
Tout d'abord, ils prêtent attention aux particularités de la croissance des micro-organismes sur le milieu et font un frottis en le colorant avec la méthode de Gram, afin de vérifier la pureté de la culture. Si des bactéries de même type de morphologie, de taille et de propriétés tinctoriales (aptitude à peindre) sont observées au microscope, on en conclut que la culture est pure. Dans certains cas, déjà en apparence et les caractéristiques de leur croissance, il est possible de tirer une conclusion sur le type d'agents pathogènes isolés. La détermination du type de bactéries par leurs caractéristiques morphologiques est appelée identification morphologique.La détermination du type d'agents pathogènes par leurs caractéristiques culturelles s'appelle l'identification culturelle.
Cependant, ces études ne suffisent pas pour tirer une conclusion définitive sur le type de microbes isolés. Par conséquent, ils étudient les propriétés biochimiques des bactéries. Ils sont assez divers.
-
Identification des bactéries.
La détermination du type d'agent pathogène par ses propriétés biochimiques est appelée identification biochimique.
Afin d'établir les espèces de bactéries, leur structure antigénique est souvent étudiée, c'est-à-dire qu'elles sont identifiées par des propriétés antigéniques. Chaque micro-organisme contient des substances antigéniques différentes. En particulier, les représentants de la famille des entérobactéries (Yesherichia, Salmoneli, Shigela) contiennent un antigène O membranaire, un antigène H flagellé et un antigène K capsulaire. Ils sont hétérogènes dans leur composition chimique, ils existent donc sous de nombreuses variantes. Ils peuvent être déterminés à l'aide de sérums agglutinants spécifiques. Cette définition du type de bactérie est appelée identification sérologique.
Parfois, les bactéries sont identifiées en infectant des animaux de laboratoire avec une culture pure et en observant les changements que les agents pathogènes provoquent dans le corps (tuberculose, botulisme, tétanos, salmonellose, etc.). Cette méthode s'appelle identification par propriétés biologiques... En tant qu'objets, les cobayes, les souris blanches et les rats sont le plus souvent utilisés.
ANNEXES
(tableaux et schémas)
Physiologie des bactéries
Schéma 1. Physiologie des bactéries.
aliments
souffle
croissance
la reproduction
poussant sur des milieux nutritifs
Tableau 1. Tableau général de la physiologie bactérienne.
|
№ |
Concept |
Caractéristique |
|
Aliments |
Le processus d'acquisition d'énergie et de substances. |
|
|
Souffle |
Un ensemble de processus biochimiques, à la suite desquels l'énergie nécessaire à l'activité vitale des cellules microbiennes est libérée. |
|
|
Croissance |
Reproduction coordonnée de tous les composants et structures cellulaires, conduisant finalement à une augmentation de la masse cellulaire |
|
|
la reproduction |
Augmentation du nombre de cellules dans la population |
|
|
Culture sur milieux nutritifs. |
En conditions de laboratoire, les microorganismes sont cultivés sur des milieux nutritifs qui doivent être stériles, transparents, humides, contenir certains nutriments (protéines, glucides, vitamines, oligo-éléments, etc.), avoir un certain pouvoir tampon, avoir un pH approprié, un potentiel redox. |
Tableau 1.1 Composition chimique et fonctions physiologiques des éléments.
|
№ |
Élément de composition |
Caractéristiques et rôle dans la physiologie cellulaire. |
|
|
Eau |
Le composant principal d'une cellule bactérienne, représentant environ 80% de sa masse. Il est à l'état libre ou lié avec les éléments structurels de la cellule. En cas de litige, la quantité d'eau est réduite à 18,20 %. L'eau est un solvant pour de nombreuses substances et joue également un rôle mécanique en fournissant de la turgescence. Lors de la plasmolyse - la perte d'eau par la cellule dans une solution hypertonique - le protoplasme se détache de la membrane cellulaire. Élimination de l'eau de la cellule, séchage, suspension des processus métaboliques. La plupart des micro-organismes tolèrent bien le séchage. Avec un manque d'eau, les micro-organismes ne se multiplient pas. Le séchage sous vide à partir d'un état congelé (lyophilisation) arrête la reproduction et favorise la préservation à long terme des individus microbiens. |
||
|
Protéine |
40 - 80% de matière sèche. Ils déterminent les propriétés biologiques les plus importantes des bactéries et consistent généralement en des combinaisons de 20 acides aminés. Les bactéries comprennent l'acide diaminopimélique (DAP), qui est absent dans les cellules humaines et animales. Les bactéries contiennent plus de 2000 protéines différentes présentes dans les composants structurels et impliquées dans les processus métaboliques. La plupart des protéines ont une activité enzymatique.Les protéines de la cellule bactérienne déterminent l'antigénicité et l'immunogénicité, la virulence et les espèces de bactéries. |
||
|
№ |
Élément de composition |
Caractéristiques et rôle dans la physiologie cellulaire. |
|
|
Acides nucléiques |
Ils remplissent des fonctions similaires aux acides nucléiques des cellules eucaryotes : une molécule d'ADN sous forme de chromosome est responsable de l'hérédité, les acides ribonucléiques (informationnels, ou matriciels, de transport et ribosomiques) sont impliqués dans la biosynthèse des protéines. |
||
|
Les glucides |
Ils sont représentés par des substances simples (mono- et disaccharides) et des composés complexes. Les polysaccharides se trouvent souvent dans les capsules. Certains polysaccharides intracellulaires (amidon, glycogène, etc.) sont des nutriments de réserve. |
||
|
Lipides |
Ils font partie de la membrane cytoplasmique et de ses dérivés, ainsi que de la paroi cellulaire des bactéries, par exemple, la membrane externe, où, en plus de la couche biomoléculaire de lipides, se trouve le LPS. Les lipides peuvent jouer le rôle de nutriments de réserve dans le cytoplasme. Les lipides bactériens sont représentés par les phospholipides, les acides gras et les glycérides. Mycobacterium tuberculosis contient la plus grande quantité de lipides (jusqu'à 40 %). |
||
|
Minéraux |
Trouvé dans les cendres après la combustion des cellules. Le phosphore, le potassium, le sodium, le soufre, le fer, le calcium, le magnésium, ainsi que des oligo-éléments (zinc, cuivre, cobalt, baryum, manganèse, etc.) sont détectés en grande quantité et participent à la régulation de la pression osmotique, du pH du milieu, le potentiel redox , activent les enzymes, font partie des enzymes, des vitamines et des composants structurels de la cellule microbienne. |
||
Tableau 1.2. Bases azotées.
|
№ |
Bases azotées |
Caractéristique |
Noter |
|
Purines |
Adénine, Guanine |
Composition nucléotidique : désoxyribose, bases azotées - adénine, guanine, cytosine, thymine, résidu H3PO4. Complémentarité des bases azotées A = T, G = C. Double hélice. Capable de doubler automatiquement |
|
|
Pyrimidine |
Cytosine, Timin ou Uracil (pour l'ARN au lieu de Timin) |
Tableau 1.2.1 Enzymes
|
№ |
Signer |
Caractéristique |
|
|
Définition |
Catalyseurs protéiques spécifiques et efficaces présents dans toutes les cellules vivantes. |
||
|
Les fonctions |
Les enzymes réduisent l'énergie d'activation, provoquant l'apparition de telles réactions chimiques qui, sans elles, ne pourraient avoir lieu qu'à des températures élevées, une pression excessive et dans d'autres conditions non physiologiques inacceptables pour une cellule vivante. |
||
|
Les enzymes augmentent la vitesse de réaction d'environ 10 ordres de grandeur, ce qui réduit la demi-vie de toute réaction de 300 ans à une seconde. |
|||
|
Les enzymes « reconnaissent » un substrat par l'agencement spatial de sa molécule et la répartition des charges qu'il contient. Une certaine partie de la molécule de protéine enzymatique - son centre catalytique - est responsable de la liaison au substrat. Dans ce cas, un complexe intermédiaire enzyme-substrat se forme, qui se décompose ensuite avec formation d'un produit de réaction et d'une enzyme libre. |
|||
|
Variétés |
Les enzymes régulatrices (allostériques) perçoivent divers signaux métaboliques et, en conséquence, modifient leur activité catalytique. |
Enzymes effectrices - enzymes qui catalysent certaines réactions (pour plus de détails, voir le tableau 1.2.2.) |
|
|
Activité fonctionnelle |
L'activité fonctionnelle des enzymes et la vitesse des réactions enzymatiques dépendent des conditions dans lesquelles se trouve le microorganisme et surtout de la température du milieu et de son pH. Pour de nombreux micro-organismes pathogènes, la température optimale est de 37 ° C et un pH de 7,2 à 7,4. |
||
COURS D'ENZYMES :
-
les micro-organismes synthétisent diverses enzymes appartenant aux six classes connues.
Tableau 1.2.2. Classes d'enzymes effectrices
|
№ |
Classe d'enzymes |
Catalyse : |
|
Oxydoréductase |
Transfert d'électrons |
|
|
Transferts |
Transfert de divers groupes chimiques |
|
|
Hydrolases |
Transfert de groupes fonctionnels à une molécule d'eau |
|
|
Lyases |
Attachement de groupes sur des doubles liaisons et réactions inverses |
|
|
Isomérase |
Transfert de groupes au sein d'une molécule avec formation de formes isomères |
|
|
Ligas |
Formation de liaisons C-C, C-S, C-O, C-N en raison de réactions de condensation associées à la décomposition de l'adénosine triphosphate (ATP) |
Tableau 1.2.3. Types d'enzymes par formation dans une cellule bactérienne
|
№ |
Un type |
Caractéristique |
Remarques (modifier) |
|
Iiductible (adaptatif) enzymes "Induction de substrat" |
|
||
|
Enzymes répressives |
La synthèse de ces enzymes est supprimée en raison d'une accumulation excessive du produit de réaction catalysé par cette enzyme. |
Un exemple de répression enzymatique est la synthèse du tryptophane, qui est formé à partir d'acide anthranilique avec la participation d'anthranilate synthétase. |
|
|
Enzymes constitutives |
Enzymes synthétisées quelles que soient les conditions environnementales |
Enzymes de la glycolyse |
|
|
Complexes multienzymatiques |
Enzymes intracellulaires combinées structurellement et fonctionnellement |
Enzymes de la chaîne respiratoire localisées sur la membrane cytoplasmique. |
Tableau 1.2.4. Enzymes spécifiques
|
№ |
Enzymes |
Identification des bactéries |
|
Superoxyde dismutase et catalase |
Tous les aérobies ou anaérobies facultatifs possèdent de la superoxyde dismutase et de la catalase - des enzymes qui protègent la cellule des produits toxiques du métabolisme de l'oxygène. Presque tous les anaérobies obligatoires ne synthétisent pas ces enzymes. Un seul groupe de bactéries aérobies - les bactéries lactiques sont catalase-négatives. |
|
|
Peroxydase |
Les bactéries lactiques accumulent la peroxydase, une enzyme qui catalyse l'oxydation des composés organiques sous l'action de H2O2 (réduit en eau). |
|
|
Arginine dihydrolase |
Une caractéristique diagnostique qui permet de distinguer les espèces saprophytes de Pseudomonas des espèces phytopathogènes. |
|
|
Uréaza |
Parmi les cinq principaux groupes de la famille des Enterobacteriaceae, seuls deux - Escherichiae et Erwiniae - ne synthétisent pas d'uréase. |
Tableau 1.2.5. Application des enzymes bactériennes en microbiologie industrielle.
|
№ |
Enzymes |
Application |
|
Amylase, cellulase, protéase, lipase |
Pour améliorer la digestion, on utilise des préparations prêtes à l'emploi d'enzymes qui facilitent l'hydrolyse de l'amidon, de la cellulose, des protéines et des lipides, respectivement. |
|
|
Invertase de levure |
Dans la fabrication de bonbons pour éviter la cristallisation du saccharose |
|
|
pectinases |
Utilisé pour clarifier les jus de fruits |
|
|
Collagénase de clostridium et streptokinase de streptocoques |
Hydrolyse les protéines, favorise la cicatrisation des plaies et des brûlures |
|
|
Enzymes lytiques des bactéries |
Ils sont sécrétés dans l'environnement, agissent sur les parois cellulaires des microorganismes pathogènes et constituent un moyen efficace de lutte contre ces derniers, même s'ils présentent de multiples résistances aux antibiotiques. |
|
|
Ribonucléases, désoxyribonucléases, polymérases, ADN ligases et autres enzymes qui modifient spécifiquement les acides nucléiques |
Utilisé comme boîte à outils en chimie bioorganique, génie génétique et thérapie génique |
Tableau 1.2.6. Classification des enzymes par localisation.
|
№ |
Classer |
Localisation |
Les fonctions |
|
Endozymes |
|
Ils ne fonctionnent qu'à l'intérieur de la cellule. Ils catalysent les réactions de biosynthèse et de métabolisme énergétique. |
|
|
Exozymes |
Sont rejetés dans l'environnement. |
Ils sont libérés par la cellule dans l'environnement et catalysent les réactions d'hydrolyse de composés organiques complexes en composés plus simples disponibles pour l'assimilation par la cellule microbienne. Il s'agit notamment des enzymes hydrolytiques, qui jouent un rôle extrêmement important dans la nutrition des micro-organismes. |
Tableau 1.2.7.Enzymes de microbes pathogènes (enzymes d'agression)
|
№ |
Enzymes |
Une fonction |
La formation de certaines enzymes en laboratoire |
|
Lécitovitellase = lécithinase |
Détruit les membranes cellulaires |
|
|
|
Hémolysine |
Détruit les globules rouges |
|
|
|
Cultures coagulase-positives |
Provoque la coagulation du plasma sanguin |
|
|
|
Cultures coagulase négatives |
Production de mannitol |
|
|
|
№ |
Enzymes |
Une fonction |
La formation de certaines enzymes en laboratoire |
|
Hyaluronidase |
Hydrolyse l'acide hyaluronique - le composant principal du tissu conjonctif |
|
|
|
Neuraminidase |
Il clive l'acide sialique (neuraminique) de diverses glycoprotéines, glycolipides, polysaccharides, augmentant ainsi la perméabilité de divers tissus. |
Détection : la réaction pour la détermination des anticorps contre la neuraminidase (RINA) et autres (méthodes immunodiffusion, immunoenzymatique et radio-immune). |
Tableau 1.2.8. Classification des enzymes par propriétés biochimiques.
|
№ |
Enzymes |
Une fonction |
Détection |
|
Sugarolytique |
Décomposition des sucres |
Différentiel - environnements de diagnostic tels que l'environnement de Giss, l'environnement d'Olkénitsky, l'environnement d'Endo, l'environnement de Levin, l'environnement de Ploskirev. |
|
|
Protéolytique |
Décomposition des protéines |
Les microbes sont inoculés avec une injection dans une colonne de gélatine, et après 3-5 jours d'incubation à température ambiante, le caractère de liquéfaction de la gélatine est noté. L'activité protéolytique est également déterminée par la formation de produits de décomposition de protéines : indole, sulfure d'hydrogène, ammoniac. Pour les déterminer, des micro-organismes sont inoculés dans un bouillon de viande-peptone. |
|
|
Enzymes du produit final |
|
Pour distinguer certains types de bactéries des autres sur la base de leur activité enzymatique, ils sont utilisésenvironnements de diagnostic différentiel |
Schéma 1.2.8. Composition enzymatique.
COMPOSITION ENZYMIQUE DE TOUT MICRO-ORGANISME :
Défini par son génome
Est un signe stable
Largement utilisé pour les identifier
Détermination des propriétés saccharolytiques, protéolytiques et autres.
Tableau 1.3. Pigments
|
№ |
Pigments |
Synthèse de micro-organismes |
|
Pigments caroténoïdes liposolubles en rouge, orange ou jaune |
Ils forment des sarcins, Mycobacterium tuberculosis, certains actinomycètes. Ces pigments les protègent des rayons UV. |
|
|
Pigments noirs ou bruns - mélanines |
Synthétisé par les anaérobies obligatoires Bacteroides niger et autres, insolubles dans l'eau et même les acides forts |
|
|
Pigment pyrrole rouge vif - prodigiosine |
Formé par quelques sérations |
|
|
Pigment phénosine hydrosoluble - pyocyanine. |
Produit par la bactérie Pseudomonas aeruginosa (Pseudomonas aeruginosa). Dans ce cas, le milieu de culture à pH neutre ou alcalin vire au bleu-vert. |
Tableau 1.4. Micro-organismes lumineux et aromatiques
|
№ |
Phénomène |
État et caractéristique |
|
Lueur (luminescence) |
Les bactéries provoquent la luminescence de ces substrats, par exemple les écailles de poisson, les champignons supérieurs, les arbres en décomposition, les produits alimentaires, à la surface desquels elles se multiplient.La plupart des bactéries luminescentes sont des espèces halophiles qui peuvent se multiplier à des concentrations élevées de sel. Ils vivent dans les mers et les océans et rarement dans les plans d'eau douce. Toutes les bactéries luminescentes sont aérobies. Le mécanisme de luminescence est associé à la libération d'énergie lors de l'oxydation biologique du substrat. |
|
|
Formation d'arôme |
Certains micro-organismes produisent des substances aromatiques volatiles, telles que l'acétate d'éthyle et l'ester amylique, qui confèrent un arôme au vin, à la bière, à l'acide lactique et à d'autres produits alimentaires, et sont donc utilisés dans leur production. |
Tableau 2.1.1 Métabolisme
|
№ |
Concept |
Définition |
|
|
Métabolisme |
Les processus biochimiques dans la cellule sont unis par un mot - métabolisme (métabole grec - transformation). Ce terme équivaut à la notion de « métabolisme et énergie ». Le métabolisme comporte deux aspects : l'anabolisme et le catabolisme. |
||
|
|
||
|
amphibolisme |
Le métabolisme intermédiaire, qui convertit des fragments de nutriments de faible poids moléculaire en un certain nombre d'acides organiques et d'esters phosphoriques, est appelé |
||
Schéma 2.1.1. Métabolisme
MÉTABOLISME -
un ensemble de deux processus opposés mais en interaction : le catabolisme et l'anabolisme
avec
Anabolisme= assimilation = métabolisme plastique = métabolisme constructif
Catabolisme= dissimilation = métabolisme énergétique = désintégration = fournir de l'énergie à la cellule
Synthèse (des composants cellulaires)
Réactions cataboliques enzymatiques entraînant libération d'énergie, qui s'est accumulé dans les molécules d'ATP.
Biosynthèse des monomères :
acides aminés nucléotides monosaccharides d'acides gras
Biosynthèse des polymères :
protéines d'acide nucléique, polysaccharides lipidiques
À la suite d'une réaction anabolique enzymatique, l'énergie libérée au cours du processus de catabolisme est dépensée pour la synthèse de macromolécules de composés organiques, à partir desquelles sont ensuite assemblés des biopolymères - composants de la cellule microbienne.
L'énergie est dépensée pour la synthèse des composants cellulaires
Tableau 2.1.3. Métabolisme et transformation de l'énergie cellulaire.
|
№ |
Métabolisme |
Caractéristique |
Remarques (modifier) |
|
Une fonction |
Le métabolisme fournit un équilibre dynamique inhérent à un organisme vivant en tant que système, dans lequel la synthèse et la destruction, la reproduction et la mort s'équilibrent mutuellement. |
Le métabolisme est le signe principal de la vie |
|
|
Échange plastique Synthèse de protéines, lipides, glucides. |
Il s'agit d'un ensemble de réactions de synthèse biologique. |
À partir de substances entrant dans la cellule de l'extérieur, des molécules se forment, similaires aux composés cellulaires, c'est-à-dire qu'une assimilation se produit. |
|
|
Échange d'énergie pourriture |
Le processus est à l'opposé de la synthèse. Il s'agit d'un ensemble de réactions de clivage. |
Lorsque des composés de haut poids moléculaire sont divisés, de l'énergie est libérée, ce qui est nécessaire à la réaction de biosynthèse, c'est-à-dire qu'une dissimilation se produit.
|
Tableau 2.1.2. Différence de métabolisme pour l'identification.
|
№ |
Paramètres |
|
La capacité d'utiliser diverses substances comme source de carbone. |
|
|
La capacité à former des produits finaux spécifiques à la suite de la décomposition des substrats. |
|
|
La capacité de mélanger le pH du milieu de culture au côté acide ou alcalin.Le métabolisme de la plupart des bactéries s'effectue par des réactions biochimiques de décomposition de substances organiques (moins souvent inorganiques) et la synthèse de composants cellulaires bactériens à partir de composés simples contenant du carbone. |
Tableau 2.2 Anabolisme (métabolisme constructif)
|
№ |
Groupe de réaction anabolique |
Synthétisé : |
|
Biosynthèse des monomères |
Acides aminés, nucléotides, monosaccharides, acides gras |
|
|
Biosynthèse des polymères |
Protéines, acides nucléiques, polysaccharides et lipides |
Schéma 2.2.2. Biosynthèse des acides aminés chez les procaryotes.
Auteur - L.B. Borisov, page 52 "Microbiologie médicale"

Schéma 2.2.1. Biosynthèse des glucides dans les micro-organismes.
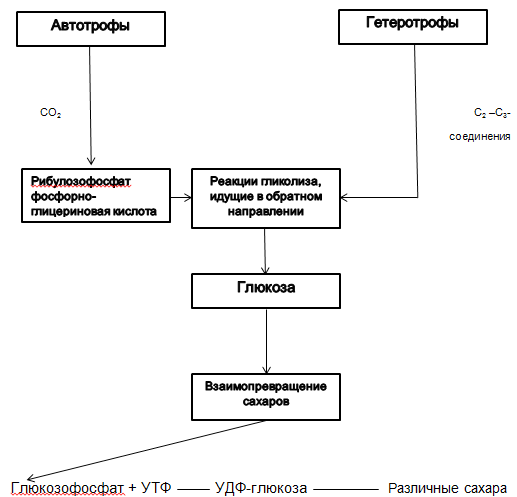
Auteur - L.B. Borisov, page 51 "Microbiologie médicale"
Graphique 2.2.3. Biosynthèse des lipides
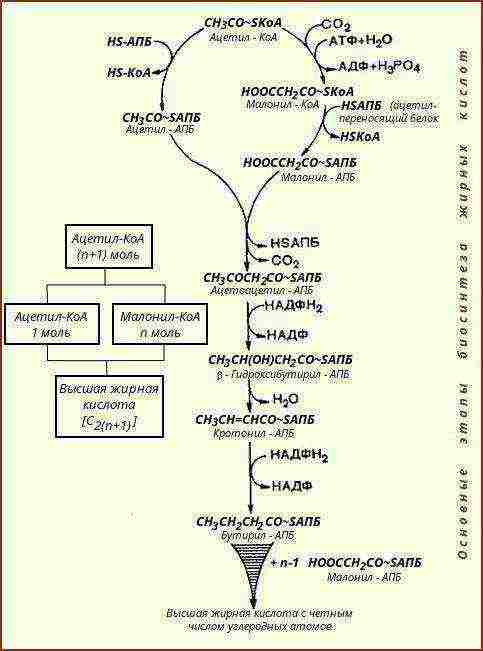
Tableau 2.2.4. Étapes du métabolisme énergétique - Catabolisme.
|
№ |
Étapes |
Caractéristique |
Noter |
|
Préparatoire |
Molécules de disaccharides et de polysaccharides, les protéines se décomposent en petites molécules - glucose, glycérine et acides gras, acides aminés. Grandes molécules d'acide nucléique par nucléotide. |
A ce stade, une petite quantité d'énergie est libérée, qui est dissipée sous forme de chaleur. |
|
|
Anoxique ou incomplète ou anaérobie ou fermentée ou dissipé. |
Les substances formées à ce stade avec la participation d'enzymes sont encore dégradées. Par exemple : le glucose se décompose en deux molécules d'acide lactique et deux molécules d'ATP. |
L'ATP et le H3PO4 sont impliqués dans les réactions de clivage du glucose. Lors de la décomposition sans oxygène du glucose, 40 % de l'énergie est stockée dans la molécule d'ATP sous forme de liaison chimique, le reste est dissipée sous forme de chaleur. Dans tous les cas de dégradation d'une molécule de glucose, deux molécules d'ATP sont formées. |
|
|
Le stade de la respiration aérobie ou de la dégradation de l'oxygène. |
Lorsque l'oxygène est disponible pour la cellule, les substances formées au cours de l'étape précédente sont oxydées (décomposées) en produits finauxCO et HO. |
L'équation totale de la respiration aérobie :
|
Schéma 2.2.4. Fermentation.
Métabolisme fermentaire -caractérisé par la formation d'ATP par phosphorylation de substrats.
-
Première (oxydation) = clivage
-
Deuxième (récupération)
Comprend la conversion du glucose en acide pyruvique.
Comprend la récupération d'hydrogène pour la récupération d'acide pyruvique.
Voies de formation de l'acide pyruvique à partir des glucides
Schéma 2.2.5. Acide pyruvique.
Voie glycolytique (voie Embden-Meyerhof-Parnassus)
Chemin Entner-Dudorov
Voie du pentose phosphate
Tableau 2.2.5. Fermentation.
|
№ |
Type de fermentation |
Représentants |
Produit final |
Remarques (modifier) |
|
Acide lactique |
|
Forme de l'acide lactique à partir du pyruvate |
Dans certains cas (fermentation par homofermentation) seul l'acide lactique se forme, dans d'autres également des sous-produits. |
|
|
Acide formique |
|
L'acide formique est l'un des produits finaux. (avec elle - côté) |
Certains types d'entérobactéries décomposent l'acide formique en H2 et CO2 / |
|
|
Acide butyrique |
|
Acide butyrique et sous-produits |
Certains types de clostridies, ainsi que les acides butyrique et autres, forment du butanol, de l'acétone, etc. (on parle alors de fermentation acétone-butyle). |
|
|
L'acide propionique |
|
Forme de l'acide propionique à partir du pyruvate |
De nombreuses bactéries fermentent les glucides avec d'autres aliments pour former de l'alcool éthylique. Cependant, ce n'est pas un produit principal. |
Tableau 2.3.1. Système de synthèse des protéines, échange d'ions.
|
№ |
Nom de l'article |
Caractéristique |
|
Sous-unités ribosomiques 30S et 50S |
Dans le cas des ribosomes bactériens 70S, la sous-unité 50S contient de l'ARNr 23S (environ 3000 nucléotides de longueur) et la sous-unité 30S contient de l'ARNr 16S (environ 1500 nucléotides de longueur); la grande sous-unité ribosomique, en plus de l'ARNr « long », contient également un ou deux ARNr « courts » (ARNr 5S des sous-unités ribosomiques bactériennes 50S ou 5S et ARNr 5.8S des grandes sous-unités ribosomiques des eucaryotes). (Pour plus de détails, voir Fig. 2.3.1.) |
|
|
ARN messager (ARNm) |
ARN contenant des informations sur la structure primaire (séquence d'acides aminés) des protéines |
|
|
Un ensemble complet de vingt aminoacyl-ARNt, pour la formation desquels les acides aminés correspondants sont nécessaires, aminoacyl-ARNt synthétases, ARNt et ATP |
C'est un acide aminé chargé d'énergie et lié à l'ARNt, prêt à être transporté vers le ribosome et incorporé dans le polypeptide synthétisé sur celui-ci. |
|
|
ARN de transport (ARNt) |
Acide ribonucléique, dont la fonction est de transporter les acides aminés vers le site de synthèse des protéines. |
|
|
Facteurs d'initiation des protéines |
(chez les procaryotes - IF-1, IF-2, IF-3) Ils tirent leur nom du fait qu'ils sont impliqués dans l'organisation d'un complexe actif (708-complexe) de sous-unités 30S et 50S, d'ARNm et d'aminoacyl-ARNt initiateur (chez procaryotes - formylméthionyl -ARNt), qui "démarre" (initie) le travail des ribosomes - la traduction de l'ARNm. |
|
|
Facteurs d'allongement des protéines |
(chez les procaryotes - EF-Tu, EF-Ts, EF-G) Participer à l'élongation (élongation) de la chaîne polypeptidique synthétisée (peptidil). Les facteurs de libération des protéines (RF) assurent la séparation spécifique du codon du polypeptide du ribosome et l'arrêt de la synthèse des protéines. |
|
|
№ |
Nom de l'article |
Caractéristique |
|
Facteurs de terminaison des protéines |
(chez les procaryotes - RF-1, RF-2, RF-3) |
|
|
Certains autres facteurs protéiques (associations, dissociation de sous-unités, libération, etc.). |
Facteurs de traduction des protéines nécessaires au fonctionnement du système |
|
|
Guanosine triphosphate (GTP) |
Pour la diffusion, la participation de GTF est requise. Le besoin du système de synthèse de protéines pour le GTP est très spécifique : il ne peut être remplacé par aucun des autres triphosphates. La cellule dépense plus d'énergie pour la biosynthèse des protéines que pour la synthèse de tout autre biopolymère. La formation de chaque nouvelle liaison peptidique nécessite le clivage de quatre liaisons à haute énergie (ATP et GTP): deux afin de charger la molécule d'ARNt avec un acide aminé, et deux autres pendant l'élongation - une pendant la liaison aa-ARNt et l'autre lors de la translocation. |
|
|
Cations inorganiques à une certaine concentration. |
Maintenir le pH du système dans les limites physiologiques. Les ions ammonium sont utilisés par certaines bactéries pour synthétiser des acides aminés, les ions potassium sont utilisés pour lier l'ARNt aux ribosomes. Les ions fer et magnésium jouent le rôle de cofacteur dans un certain nombre de processus enzymatiques |
Graphique 2.3.1. Représentation schématique des structures des ribosomes procaryotes et eucaryotes.
Auteur - Korotyaev, page 68 "Microbiologie médicale"
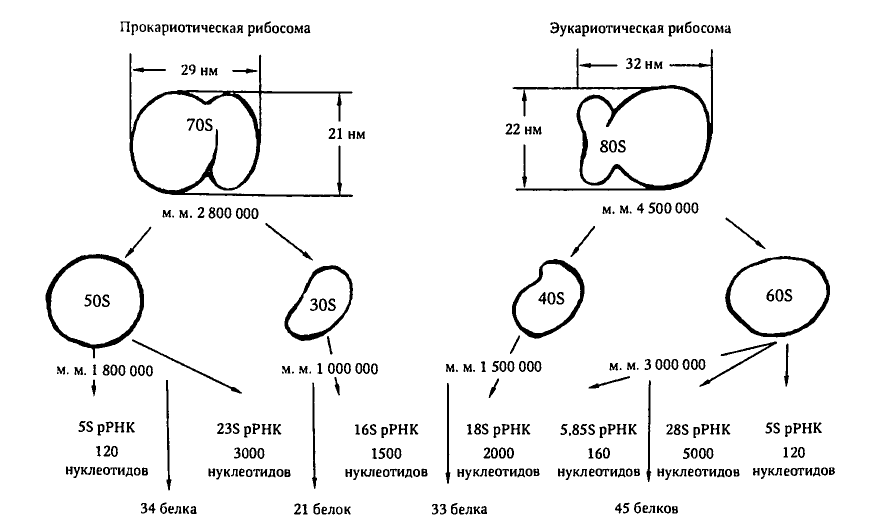
Tableau 2.3.2. Caractéristiques de l'échange d'ions chez les bactéries.
|
№ |
Particularité |
Caractérisé par: |
|
|
Pression osmotique élevée |
En raison de la concentration intracellulaire importante d'ions potassium dans les bactéries, une pression osmotique élevée est maintenue. |
||
|
Apport en fer |
Pour un certain nombre de bactéries pathogènes et opportunistes (Escherichia, Shigella, etc.), la consommation de fer dans l'organisme de l'hôte est difficile en raison de son insolubilité aux pH neutres et légèrement alcalins. |
Sidérophores -substances spéciales qui, en liant le fer, le rendent soluble et transportable. |
|
|
Assimilation |
Les bactéries assimilent activement les anions SO2/ et PO34+ de l'environnement pour la synthèse de composés contenant ces éléments (acides aminés soufrés, phospholipides, etc.). |
||
|
Jonas |
Pour la croissance et la reproduction des bactéries, des composés minéraux sont nécessaires - ions NH4 +, K +, Mg2 +, etc. (pour plus de détails, voir le tableau 2.3.1.) |
||
Tableau 2.3.3. Échange d'ion
|
№ |
Nom des composés minéraux |
Une fonction |
|
NH4 + (ions ammonium) |
Utilisé par certaines bactéries pour synthétiser des acides aminés |
|
|
K + (ions potassium) |
|
|
|
Fe2 + (ions fer) |
|
|
|
Mg2 + (ions magnésium) |
||
|
SO42- (anion sulfate) |
Nécessaire à la synthèse de composés contenant ces éléments (acides aminés soufrés, phospholipides, etc.) |
|
|
PO43- (anion phosphate) |
Schéma 2.4.1. Le métabolisme énergétique.
Pour la synthèse, les bactéries ont besoin...
-
Nutriments
-
Énergie
Tableau 2.4.1. Métabolisme énergétique (oxydation biologique).
|
№ |
Traiter |
Nécessaire: |
|
Synthèse des composants structurels des cellules microbiennes et maintien des processus vitaux |
Quantité d'énergie suffisante. Ce besoin est satisfait par l'oxydation biologique, à la suite de laquelle des molécules d'ATP sont synthétisées. |
|
|
Énergie (ATP) |
Les bactéries du fer reçoivent l'énergie libérée lors de leur oxydation directe du fer (Fe2+ en Fe3+), qui sert à fixer le CO2, les bactéries métabolisant le soufre, se fournissent en énergie grâce à l'oxydation des composés soufrés. Cependant, la grande majorité des procaryotes obtiennent de l'énergie par déshydrogénation. L'énergie est également reçue lors de la respiration (pour un tableau détaillé, voir la section correspondante). |
Schéma 2.4. Oxydation biologique chez les procaryotes.
Décomposition des polymères en monomères
Étape I
Protéine
Graisses
Les glucides
glycérine et acides gras
acides aminés
monosaccharides
Décomposition en conditions anoxiques
II étape
Formation de produits intermédiaires
Oxydation dans des conditions d'oxygène aux produits finaux
Stade III
CO2
H2O
Tableau 2.4.2. Le métabolisme énergétique.
|
№ |
Concept |
Caractéristique |
|
Essence du métabolisme énergétique |
Fournir l'énergie des cellules nécessaire à la manifestation de la vie. |
|
|
ATF |
La molécule d'ATP est synthétisée à la suite du transfert d'un électron de son donneur primaire à l'accepteur final. |
|
|
Souffle |
|
|
|
Mobiliser l'énergie |
L'énergie est mobilisée dans les réactions d'oxydation et de réduction. |
|
|
Réaction d'oxydation |
La capacité d'une substance à donner des électrons (oxyder) |
|
|
Réaction de récupération |
Capacité d'une substance à attacher des électrons. |
|
|
Potentiel redox |
Capacité d'une substance à donner (oxyder) ou à recevoir (récupérer) des électrons. (expression quantitative) |
Schéma 2.5. Synthèse.
SYNTHÈSE
protéines
gros
les glucides
Tableau 2.5.1. Synthèse
|
№ |
Nom |
Caractéristique |
|
Cytoplasme |
La synthèse des produits initiaux a lieu dans le cytoplasme. |
|
|
Membrane cytoplasmique |
Les produits initiaux du cytoplasme sont transférés à la surface externe de la membrane cytoplasmique. |
|
|
Morphogenèse |
Sur le CPM, commence la morphogenèse, c'est-à-dire la formation de structures cellulaires (capsules, parois cellulaires, etc.) avec la participation d'enzymes. |
Tableau 2.5.1. Synthèse
|
№ |
Biosynthèse |
De quoi |
Remarques (modifier) |
|
je |
Biosynthèse des glucides |
Les autotrophes synthétisent le glucose à partir du CO2. Les hétérotrophes synthétisent le glucose à partir de composés contenant du carbone. |
Cycle de Calvin (voir schéma 2.2.1.) |
|
II |
Biosynthèse des acides aminés |
La plupart des procaryotes sont capables de synthétiser tous les acides aminés à partir de :
|
La source d'énergie est l'ATP. Le pyruvate est formé dans le cycle glycolytique. Micro-organismes auxotrophes - consommés prêts à l'emploi dans le corps de l'hôte. |
|
III |
Biosynthèse des lipides |
Les lipides sont synthétisés à partir de composés plus simples - produits métaboliques des protéines et des glucides |
Les protéines de transfert d'acétyle jouent un rôle important. Micro-organismes auxotrophes - à consommer prêts à l'emploi dans le corps de l'hôte ou à partir de milieux nutritifs. |
Tableau 2.5.2. Les principales étapes de la biosynthèse des protéines.
|
№ |
Étapes |
Caractéristique |
Remarques (modifier) |
|
Transcription |
Le processus de synthèse d'ARN sur les gènes. C'est le processus de réécriture des informations de l'ADN - gène en ARNm - gène. |
Elle est réalisée à l'aide d'ADN - ARN - polymérase dépendante. Le transfert d'informations sur la structure de la protéine aux ribosomes se fait à l'aide de l'ARNm. |
|
|
Diffusion (transmission) |
Le processus de la propre biosynthèse des protéines. Processus de décodage du code génétique dans l'ARNm et de sa mise en œuvre sous la forme d'une chaîne polypeptidique. |
Puisque chaque codon contient trois nucléotides, le même texte génétique peut être lu de trois manières différentes (en commençant par les premier, deuxième et troisième nucléotides), c'est-à-dire dans trois cadres de lecture différents. |
-
Remarque concernant le tableau : la structure principale de chaque protéine est la séquence d'acides aminés qu'elle contient.
Schéma 2.5.2. Chaînes de transfert d'électrons du donneur primaire d'hydrogène (électrons) à son accepteur final O2.
Matière organique
(donneur d'électrons primaire)
NAD (- 0,32)
Flavoprotéine (- 0,20)
Quinone (- 0, 07)
Cytochrome (+0,01)
Cytochrome C (+0,22)
Cytochrome A (+0,34)
O2 (+0,81)
accepteur final
Tableau 3.1. Classification des organismes par types d'aliments.
|
№ |
Élément organogène |
Types de nourriture |
Caractéristique |
|
Carbone (C) |
|
Ils synthétisent eux-mêmes tous les composants carbonés de la cellule à partir du CO2. |
|
|
Ils ne peuvent pas satisfaire leurs besoins en CO2, ils utilisent des composés organiques prêts à l'emploi. |
||
|
La source de nourriture est constituée de substrats organiques morts. |
||
|
La source de nourriture est constituée de tissus vivants d'animaux et de plantes. |
||
|
Azote (N) |
|
Satisfaire leurs besoins en azote atmosphérique et minéral |
|
|
Besoin de composés azotés organiques prêts à l'emploi. |
||
|
Hydrogène (H) |
La source principale est H2O |
||
|
Oxygène (O) |
|||
Tableau 3.1.2. Transformation énergétique
|
№ |
Classification |
Nom |
Obligatoire: |
|
Par source d'énergie |
|
lumière du soleil |
|
|
Réactions redox |
||
|
Par donneur d'électrons |
|
Composés inorganiques (H2, H2S, NH3, Fe, etc.) |
|
|
Composés organiques |
Tableau 3.1.3. Méthodes d'alimentation en carbone
|
№ |
Source d'énergie |
Donneur d'électrons |
Méthode d'alimentation en carbone |
|
Énergie solaire |
Composés inorganiques |
Photolithohétérotrophes |
|
|
Composés organiques |
Photoorganohétérotrophes |
||
|
Réactions redox |
Composés inorganiques |
Chimolithohétérotrophes |
|
|
Composés organiques |
Chimioorganohétérotrophes |
Tableau 3.2. Mécanismes de puissance :
|
№ |
Mécanisme |
Conditions |
Le gradient de concentration |
Coûts énergétiques |
Spécificité du substrat |
|
Diffusion passive |
La concentration de nutriments dans le milieu dépasse la concentration dans la cellule. |
Par gradient de concentration |
– |
– |
|
|
Diffusion facilitée |
Les protéines de perméase sont impliquées. |
Par gradient de concentration |
– |
+ |
|
|
Transport actif |
Les protéines de perméase sont impliquées. |
Contre le gradient de concentration |
+ |
+ |
|
|
3A |
Translocation de groupes chimiques |
Au cours du processus de transfert, une modification chimique des nutriments se produit. |
Contre le gradient de concentration |
+ |
+ |
Tableau 3.3. Transport des nutriments de la cellule bactérienne.
|
№ |
Nom |
Caractéristique |
|
Réaction de phosphotransférase |
Se produit lors de la phosphorylation de la molécule transférée. |
|
|
Sécrétion translationnelle |
Dans ce cas, les molécules synthétisées doivent avoir une séquence d'acides aminés principale spéciale afin de se fixer à la membrane et de former un canal à travers lequel les molécules de protéines peuvent s'échapper dans l'environnement. Ainsi, les toxines du tétanos, de la diphtérie et d'autres molécules sont libérées des cellules des bactéries correspondantes. |
|
|
bourgeonnement membranaire |
Les molécules formées dans la cellule sont entourées d'une vésicule membranaire, qui se détache dans l'environnement. |
Tableau 4. Croissance.
|
№ |
Concept |
Définition de la notion. |
|
Croissance |
Augmentation irréversible de la quantité de matière vivante, le plus souvent due à la division cellulaire.Si, dans les organismes multicellulaires, une augmentation de la taille du corps est généralement observée, alors dans les organismes multicellulaires, le nombre de cellules augmente. Mais même chez les bactéries, il faut distinguer une augmentation du nombre de cellules et une augmentation de la masse cellulaire. |
|
|
Facteurs affectant la croissance des bactéries in vitro. |
Mycobacterium leprae n'est pas capable de Croissance de Chlamydia (y compris les parasites)
|
|
|
Évaluation de la croissance bactérienne |
La quantification de la croissance est généralement effectuée dans des milieux liquides où les bactéries en croissance forment une suspension homogène. Une augmentation du nombre de cellules est établie en déterminant la concentration de bactéries dans 1 ml, ou l'augmentation de la masse cellulaire est déterminée en unités de poids par unité de volume. |
Facteurs de croissance
Lipides
Acides aminés
Vitamines
Bases azotées
Tableau 4.1. Facteurs de croissance
|
№ |
Facteurs de croissance |
Caractéristique |
Une fonction |
|
|
Acides aminés |
|
De nombreux micro-organismes, en particulier les bactéries, ont besoin d'un ou plusieurs acides aminés (un ou plusieurs), car ils ne peuvent pas les synthétiser par eux-mêmes. Les micro-organismes de ce type sont appelés auxotrophes pour les acides aminés ou autres composés qu'ils sont incapables de synthétiser. |
||
|
Bases puriques et leurs dérivés |
Nucléotides :
|
Ce sont des facteurs de croissance des bactéries. Certains types de mycoplasmes ont besoin de nucléotides. Nécessaire à la construction d'acides nucléiques. |
||
|
Bases pyrimidiques et leurs dérivés |
Nucléotides
|
|||
|
№ |
Facteurs de croissance |
Caractéristique |
Une fonction |
|
|
Lipides |
|
Fait partie des lipides membranaires |
||
|
||||
|
Sont des composants des phospholipides |
|||
|
Dans les mycoplasmes, ils font partie de la membrane cytoplasmique |
|||
|
||||
|
Vitamines (principalement groupe B) |
|
Staphylococcus aureus, pneumocoque, Brucella |
||
|
Tous les types de bactéries en forme de bâtonnets |
|||
|
Bifidobactéries et acide propionique |
|||
|
Certains types de streptocoques, bacilles tétaniques |
|||
|
Levures et bactéries fixatrices d'azote Rhizobium |
|||
|
Hèmes - composants des cytochromes |
Bactéries hémophiles, Mycobacterium tuberculosis |
|||
Tableau 5. Respiration.
|
№ |
Nom |
Caractéristique |
|
Souffle |
Oxydation biologique (réactions enzymatiques) |
|
|
Base |
La respiration est basée sur des réactions redox qui conduisent à la formation d'ATP, un accumulateur universel d'énergie chimique. |
|
|
Processus |
Lors de la respiration, les processus suivants ont lieu:
|
|
|
Respiration aérobie |
L'accepteur final d'hydrogène ou d'électrons est l'oxygène moléculaire. |
|
|
Respiration anaérobie |
L'accepteur d'hydrogène ou d'électrons est un composé inorganique - NO3-, SO42-, SO32-. |
|
|
Fermentation |
Les composés organiques sont des accepteurs d'hydrogène ou d'électrons. |
Tableau 5.1. Classement respiratoire.
|
№ |
Bactéries |
Caractéristique |
Remarques (modifier) |
|
Anaérobies stricts |
|
|
|
|
Aérobies stricts |
|
Les aérobies stricts comprennent, par exemple, les représentants du genre Pseudomonas |
|
|
№ |
Bactéries |
Caractéristique |
Remarques (modifier) |
|
Anaérobies facultatives |
|
Les anaérobies facultatifs comprennent les entérobactéries et de nombreuses levures qui peuvent passer de la respiration en présence d'O2 à la fermentation en l'absence d'O2. |
|
|
Microaérophiles |
Un micro-organisme qui nécessite, contrairement aux anaérobies stricts, la présence d'oxygène dans l'atmosphère ou le milieu nutritif pour sa croissance, mais à des concentrations réduites par rapport à la teneur en oxygène de l'air ordinaire ou des tissus normaux du corps de l'hôte (contrairement aux aérobies , pour la croissance dont teneur normale en oxygène dans l'atmosphère ou le milieu nutritif). De nombreux microaérophiles sont également capnophiles, c'est-à-dire qu'ils nécessitent une concentration accrue de dioxyde de carbone. |
En laboratoire, de tels organismes sont facilement cultivés dans un "pot à bougie". Un « pot de bougie » est un récipient dans lequel une bougie allumée est introduite avant d'être scellée avec un couvercle hermétique. La flamme de la bougie brûlera jusqu'à ce qu'elle s'éteigne à cause d'un manque d'oxygène, à la suite de quoi une atmosphère saturée de dioxyde de carbone avec une teneur réduite en oxygène se forme dans la canette. |
Tableau 6. Caractéristiques de la reproduction.
|
№ |
Nom |
Caractéristique |
|
la reproduction |
Le terme « propagation » fait référence à une augmentation du nombre de cellules dans une population. La plupart des procaryotes se reproduisent par division transversale, certains par bourgeonnement. Les champignons se reproduisent par sporulation. |
|
|
Où va |
Lorsqu'une cellule microbienne se multiplie, les processus les plus importants se produisent dans le noyau (nucléoïde), qui contient toute l'information génétique d'une molécule d'ADN double brin. |
Schéma 6. Dépendance de la durée de production sur divers facteurs.
Durée de génération
Type de bactéries
Âge
Population
Température
La composition du milieu nutritif
Tableau 6.1. Phases de reproduction bactérienne.
|
№ |
Phase |
Caractéristique |
|
je |
Phase stationnaire initiale |
Dure 1-2 heures. Pendant cette phase, le nombre de cellules bactériennes n'augmente pas. |
|
II |
Phase de latence (phase de retard de reproduction) |
Elle se caractérise par le début d'une croissance cellulaire intensive, mais le taux de division cellulaire reste faible. |
|
III |
Phase de log (logarithmique) |
Diffère dans le taux maximal de reproduction cellulaire et une augmentation exponentielle du nombre de population bactérienne |
|
IV |
Phase d'accélération négative |
Elle se caractérise par une moindre activité des cellules bactériennes et un allongement de la période de génération. Cela se produit à la suite de l'épuisement du milieu nutritif, de l'accumulation de produits métaboliques dans celui-ci et d'un manque d'oxygène. |
|
V |
État stationnaire |
Elle se caractérise par un équilibre entre le nombre de cellules mortes, nouvellement formées et dormantes. |
|
VI |
Phase de malheur |
Il se produit à un taux constant et est remplacé par des phases UP-USH de diminution du taux de mort cellulaire. |
Schéma 7. Exigences pour les milieux de culture.
Exigences
Viscosité
Humidité
Stérilité
La valeur nutritionnelle
Transparence
Isotonie
pH de l'environnement
Tableau 7. Reproduction de bactéries sur milieu nutritif.
|
№ |
Milieu nutritif |
Caractéristique |
|
|
Milieux nutritifs denses |
Sur un milieu nutritif dense, les bactéries forment des colonies - des amas de cellules. |
||
|
S - un type (lisse - lisse et brillant) Rond, avec un bord régulier, lisse, convexe. |
R - un type (rugueux - rugueux, inégal) De forme irrégulière avec des bords dentelés, rugueux, bosselé. |
||
|
Milieux de culture liquides |
|
||
Tableau 7.1. Classification des milieux de culture.
|
№ |
Classification |
Vues |
Exemples de |
|
Par composition |
Simple |
|
|
|
Complexe |
|
||
|
Sur rendez-vous |
Le principal |
|
|
|
Électif |
|
||
|
Différentiel - diagnostic |
|
||
|
Spécial |
|
||
|
Par cohérence |
Dense |
|
|
|
Liquide |
|
||
|
Semi liquide |
|
||
|
Par origine |
Naturel |
|
|
|
Semi-synthétique |
|
||
|
Synthétique |
|
Tableau 7.2. Principes d'isolement de la culture cellulaire pure.
|
Principe mécanique |
Principe biologique |
|
MÉTHODES 1. Dilutions fractionnaires de L. Pasteur 2. Dilutions de plaques R. Koch 3. Cultures de surface Drigalsky 4. Coups de surface |
MÉTHODES Envisager: a - type de respiration (méthode de Fortner) ; b - mobilité (méthode de Shukevich); c - résistance aux acides; d - sporulation; d - température optimale; e - sensibilité sélective des animaux de laboratoire aux bactéries |
Tableau 7.2.1. Étapes d'isolement de la culture cellulaire pure.
|
№ |
Étape |
Caractéristique |
|
Recherche de l'étape 1 |
Enlevez le matériel pathologique. Il est étudié - apparence, consistance, couleur, odeur et autres signes, un frottis est préparé, peint et examiné au microscope. |
|
|
Recherche de l'étape 2 |
A la surface d'un milieu nutritif dense, les micro-organismes forment une croissance continue et dense ou des colonies isolées.La colonie - Ce sont les accumulations de bactéries visibles à l'œil nu en surface ou dans l'épaisseur du milieu nutritif. En règle générale, chaque colonie est formée des descendants d'une cellule microbienne (clones), leur composition est donc assez homogène. Les caractéristiques de la croissance des bactéries sur les milieux nutritifs sont une manifestation de leurs propriétés culturelles. |
|
|
Recherche de stade 3 |
La nature de la croissance d'une culture pure de microorganismes est étudiée et son identification est réalisée. |
Tableau 7.3. Identification des bactéries.
|
№ |
Nom |
Caractéristique |
|
Identification biochimique |
Détermination du type d'agent pathogène par ses propriétés biochimiques |
|
|
Identification sérologique |
Afin d'établir les espèces de bactéries, leur structure antigénique est souvent étudiée, c'est-à-dire qu'elles sont identifiées par des propriétés antigéniques. |
|
|
Identification par propriétés biologiques |
Parfois, les bactéries sont identifiées en infectant des animaux de laboratoire avec une culture pure et en observant les changements que les agents pathogènes provoquent dans le corps. |
|
|
Identification culturelle |
Détermination du type d'agents pathogènes par leurs caractéristiques culturelles |
|
|
Identification morphologique |
Détermination du type de bactéries par leurs caractéristiques morphologiques |
Tests de contrôle de notation
-
Lequel des processus n'est pas lié à la physiologie des bactéries ?
-
Croissance
-
la reproduction
-
Mutation
-
Aliments
-
Quelles substances constituent 40 à 80 % de la masse sèche d'une cellule bactérienne ?
-
Les glucides
-
Protéine
-
Graisses
-
Acides nucléiques
-
Quelles classes d'enzymes sont synthétisées par les micro-organismes ?
-
Oxy réductase
-
Tous les cours
-
Transferts
-
Ligas
-
Des enzymes dont la concentration dans la cellule augmente fortement en réponse à l'apparition d'un substrat inducteur dans le milieu ?
-
Iiductible
-
Constitutionnel
-
Répressif
-
Complexes multienzymatiques
-
Une enzyme de pathogénicité sécrétée par Staphylococcus aureus ?
-
Neuraminidase
-
Hyaluronidase
-
Lécithinase
-
Fibrinolysine
-
Les enzymes protéolytiques remplissent-elles une fonction ?
-
Décomposition des protéines
-
Briser les graisses
-
Décomposition des glucides
-
Formation alcaline
-
Fermentation des entérobactéries ?
-
Acide lactique
-
Acide formique
-
L'acide propionique
-
Acide butyrique
-
Quels composés minéraux sont utilisés pour lier l'ARN-t aux ribosomes ?
-
NH4
-
K +
-
Fe2 +
-
Mg2 +
-
L'oxydation biologique est ...?
-
Aliments
-
la reproduction
-
Souffle
-
Mort cellulaire
-
Quelles substances elles-mêmes synthétisent tous les composants contenant du carbone de la cellule à partir du CO2.
-
Prototrophes
-
Hétérotrophes
-
Autotrophes
-
Saprophytes
-
Les milieux de culture diffèrent :
-
Par composition
-
Par cohérence
-
Sur rendez-vous
-
Tout ce qui précède
-
La phase de reproduction, qui se caractérise par un équilibre entre le nombre de cellules mortes, nouvellement formées et dormantes ?
-
Phase de latence
-
Phase de journalisation
-
Phase d'accélération négative
-
État stationnaire
-
La durée de génération dépend ?
-
Espèce
-
Âge
-
Populations
-
Tout ce qui précède
-
Afin d'établir les espèces de bactéries, leur structure antigénique est souvent étudiée, c'est-à-dire qu'une identification est effectuée, laquelle ?
-
Biologique
-
Morphologique
-
Sérologique
-
Biochimique
-
La méthode de semis en surface de Drygalski est appelée ...?
-
Principes mécaniques d'isolement de la culture pure
-
Principes biologiques d'isolement de la culture pure
Bibliographie
1. Borisov LB Microbiologie médicale, virologie, immunologie : un manuel pour le miel. universités. - M. : LLC "Agence d'information médicale", 2005.
2. Pozdeev OK Microbiologie médicale : un manuel pour le miel. universités. - M. : GEOTAR-MED, 2005.
3. Korotyaev AI, Babichev SA Microbiologie médicale, immunologie et virologie / manuel pour le miel. universités. - SPb. : SpetsLit, 2000.
4. Vorobiev A.A., Bykov A.S., Pashkov E.P., Rybakova A.M. Microbiologie : manuel. - M. : Médecine, 2003.
5. Microbiologie médicale, virologie et immunologie : manuel / éd. V. V. Zvereva, M. N. Boychenko. - M. : GEOTar-Média, 2014.
6. Guide de formation pratique en microbiologie médicale, virologie et immunologie / éd. V.V. Teza. - M. : Médecine, 2002.
Contenu
Présentation 6
La composition des bactéries du point de vue de leur physiologie. 7
Métabolisme 14
Nutrition (transport des nutriments) 25
Hauteur 29
Souffle 31
Élevage 34
Communautés microbiennes 37
ANNEXES 49
Essais 102
Références 105
…………..
…………
Certaines maladies humaines sont associées à l'exposition à des microbes sur le corps. Lorsque de telles maladies surviennent dans le corps humain, des changements complexes se produisent, des fonctions de protection sont mobilisées, visant à lutter contre les microbes piégés.
Parmi le grand nombre de micro-organismes, il y a ceux qui sont capables de provoquer des maladies chez l'homme, les animaux et les plantes. Ils sont appelés pathogènes ou pathogènes. La spécificité est caractéristique des micro-organismes pathogènes - chaque type d'entre eux n'est capable de provoquer qu'une certaine maladie avec tous ses signes caractéristiques. La plupart des micro-organismes pathogènes sont des microbes parasites, car ils sont capables de vivre des substances d'un organisme vivant.
Les microbes pathogènes produisent des substances spéciales - des toxines qui empoisonnent le corps et provoquent une affection douloureuse. La capacité des micro-organismes à provoquer une maladie est appelée pathogénicité. Il peut se manifester à des degrés divers. Le degré de pathogénicité est appelé virulence.La virulence des microbes peut augmenter ou diminuer à la fois dans des conditions naturelles et expérimentales.
Sous le terme "infection»Comprendre le processus d'interaction des microbes avec le corps humain, à la suite duquel une maladie infectieuse survient. Les sources d'infection sont tout d'abord les personnes et les animaux malades qui libèrent des agents pathogènes dans l'environnement extérieur, ainsi que les personnes et les animaux qui se sont rétablis de la maladie, dans l'organisme desquels les microbes pathogènes continuent de rester pendant un certain temps (parfois très longtemps) après récupération. Les personnes et les animaux qui libèrent des microbes pathogènes après récupération sont appelés porteurs de bactéries ou excréteurs de bactéries. Les personnes qui ne sont pas malades peuvent également être porteuses de bactéries. Les microbes pathogènes isolés par l'organisme malade pénètrent dans l'air, le sol, l'eau, les objets environnants et les aliments, où ils peuvent rester viables plus ou moins longtemps, selon le type de microbes.
Les microbes pathogènes pénètrent dans le corps humain de diverses manières: par contact direct avec une personne malade, par voie aérienne avec les plus petites gouttelettes de mucus et de salive sécrétées par le patient lorsqu'il tousse ou éternue (infection par gouttelettes). Les microbes - les agents responsables de certaines maladies - sont excrétés par les patients avec des matières fécales et de l'urine. Ces microbes pénètrent dans le corps d'une personne en bonne santé par des mains sales qui n'ont pas été lavées après avoir utilisé les toilettes. Les mains contaminées propagent également des agents pathogènes sur les aliments. Les agents responsables des infections intestinales pénètrent également dans le corps sain lorsque de l'eau contaminée est consommée.
Les insectes et les rongeurs sont souvent porteurs de maladies infectieuses. Les mouches peuvent être porteuses d'agents responsables de la fièvre typhoïde et de la dysenterie, des poux - typhus, certains types de moustiques - paludisme, etc. Les souris et les rats sont des distributeurs d'agents responsables de la peste, de la tularémie, de la fièvre charbonneuse.
La pénétration de microbes pathogènes dans le corps humain ne conduit pas toujours à sa maladie. Dans l'apparition et l'évolution de la maladie, les propriétés des microbes pathogènes qui ont pénétré dans le corps, leur nombre et leur activité, ainsi que le lieu de leur introduction dans le corps et l'état du corps lui-même jouent un rôle important.
Pour la reproduction de micro-organismes pathogènes, des conditions favorables sont nécessaires et elles apparaissent lorsque le corps humain est affaibli et que sa capacité de protection est réduite (en raison de l'hypothermie, de la famine, etc.). La susceptibilité aux infections dépend également de l'âge (chez les enfants et les personnes âgées, elle est plus élevée que chez les adultes).
À partir du moment où les microbes pathogènes pénètrent dans le corps humain jusqu'à l'apparition des signes de la maladie, un certain temps s'écoule généralement - c'est ce qu'on appelle la période de latence de la maladie, ou incubation. Pendant ce temps, il y a une multiplication des microbes pathogènes dans l'organisme et l'accumulation de produits nocifs de leur activité vitale. La durée de la période d'incubation pour différentes maladies n'est pas la même. Elle varie de quelques jours (grippe, tétanos, dysenterie) à plusieurs semaines (typhus, fièvre typhoïde), et atteint parfois plusieurs mois (rage) voire plusieurs années (lèpre).
Si vous trouvez une erreur, veuillez sélectionner un morceau de texte et appuyez sur Ctrl + Entrée.
Média culturel - substrats constitués de composants qui fournissent les conditions nécessaires à la culture de micro-organismes ou à l'accumulation de leurs déchets
.
Média culturel diffèrent par leur objectif, leur consistance et leur composition. Selon leur objectif, ils sont classiquement divisés en deux groupes principaux - les environnements de diagnostic et de production. Les milieux de culture diagnostiques comprennent cinq sous-groupes : les milieux pour cultiver une large gamme de micro-organismes ; milieu pour l'isolement d'un agent pathogène spécifique; milieux différentiels permettant de distinguer certains types de micro-organismes ; supports d'identification de micro-organismes et supports de stockage destinés à l'enrichissement d'un type spécifique de micro-organismes. La production comprend P. avec. utilisés dans la production industrielle de médicaments biologiques (vaccins bactériens, anatoxines, etc.) et le contrôle qualité.Les milieux de culture pour la production de préparations bactériennes, contrairement aux milieux de diagnostic, ne doivent pas contenir d'impuretés nocives pour l'homme et avoir un effet négatif sur le processus de production (sans interférer, notamment, avec l'élimination des produits du métabolisme microbien, les ballasts organiques et substances minérales des préparations préparées).
Par consistance, on distingue les milieux liquides, denses et semi-liquides. Les milieux nutritifs solides et semi-liquides sont préparés à partir de milieux liquides en y ajoutant de la gélose ou (moins souvent) de la gélatine. L'agar agar est un polysaccharide dérivé de certaines variétés d'algues. La gélose est généralement introduite dans P. with. à une concentration de 1-2% (dans la fabrication de milieux semi-liquides - 0,2-0,4%), gélatine - 10-15%. À t ° 25-30 °, les milieux gélatineux fondent, donc les micro-organismes y sont cultivés principalement à température ambiante. Le sérum sanguin coagulé, les œufs roulés, les pommes de terre et les milieux contenant 1,5% de gel de silice sont également utilisés comme milieux solides.
En termes de composition, les milieux de culture sont divisés en simples et complexes. Simple P. avec. couvrir les besoins nutritionnels de la plupart des micro-organismes pathogènes (bouillon mésopatamique, gélose mésopatamique, bouillon et gélose Hottinger, gélatine nutritive, eau peptonée, etc.). Les milieux complexes comprennent des milieux spéciaux pour les microbes qui ne poussent pas sur des milieux nutritifs simples. De tels milieux sont préparés en ajoutant du sang, du sérum, des glucides et d'autres substances nécessaires à la reproduction d'un micro-organisme particulier à des milieux simples. Complexe P. avec. sont également des milieux de diagnostic différentiel, par exemple des milieux Giss avec des glucides et un indicateur, utilisés pour déterminer l'espèce du microbe étudié par son activité enzymatique. Certains milieux complexes, dits sélectifs, ou électifs, sont utilisés pour l'isolement ciblé d'un ou plusieurs types de micro-organismes en créant des conditions optimales pour leur croissance et l'inhibition de la croissance de la microflore qui les accompagne. Par exemple, la gélose au sulfite de bismuth est un milieu strictement sélectif pour l'isolement de Salmonella, la gélose et le milieu de Levin sont des milieux faiblement sélectifs pour l'isolement des entérobactéries.
Selon la composition des composants initiaux, on distingue également les milieux synthétiques, semi-synthétiques et naturels. Les milieux synthétiques, dont les composants sont connus avec précision, et dans une moindre mesure semi-synthétiques, sont pratiques et sont principalement utilisés pour étudier les processus physiologiques des micro-organismes. L'utilisation de milieux de ce type permet de déterminer les exigences minimales des microorganismes individuels en nutriments et, sur cette base, de créer des milieux nutritifs contenant uniquement les composés nécessaires à la croissance d'un microbe donné. L'avantage des milieux de culture synthétiques est leur standardisation, cependant, l'utilisation de ces milieux est limitée en raison du coût élevé et de la complexité de la composition de beaucoup d'entre eux (ils contiennent souvent jusqu'à 40 ingrédients ou plus). De plus, ils sont plus sensibles aux déséquilibres entre certains composants du P.. , en particulier les acides aminés, et la croissance de micro-organismes sur de tels milieux est plus facilement supprimée par une aération excessive ou des cations toxiques.
En pratique microbiologique, ils continuent à utiliser largement les milieux d'origine naturelle dont la composition chimique est mal connue. La base de tels supports est constituée de diverses matières premières d'origine animale ou végétale : viande et ses succédanés, poisson, sang animal, caséine, levure, pomme de terre, soja, etc. une grande partie des milieux eux-mêmes.
Outre les bases protéiques, les milieux nutritifs doivent contenir des éléments de cendres (phosphore, soufre, calcium, magnésium, fer) et des oligo-éléments (bore, molybdène, cobalt, manganèse, zinc, nickel, cuivre, chlore, sodium, silicium, etc.). Ces substances sont nécessaires à de nombreux processus de biosynthèse chez les bactéries, mais leur besoin dans différents types de micro-organismes n'est pas le même. Par exemple, le manganèse et le fer sont nécessaires pour E. coli et les agents pathogènes de la peste, et le potassium pour les bactéries lactiques. Le manganèse, le calcium, le magnésium, le potassium et le fer stimulent la croissance du bacille charbonneux, et le magnésium, le fer et le manganèse stimulent la croissance de Brucella.
Pour la culture de nombreux micro-organismes pathogènes, la présence dans le milieu des facteurs dits de croissance, représentés principalement par des vitamines hydrosolubles, est nécessaire. Bien que les bactéries n'utilisent pas ces substances comme matière plastique ou énergétique, elles sont néanmoins des composants indispensables des milieux nutritifs, car leur absence inhibe la formation de nombreuses enzymes. Certains acides organiques, bases puriques et pyrimidiques et acides aminés peuvent également être des facteurs de croissance. Certains acides aminés (L-cystine, acide D-pyroglutamique, etc.) sont capables de stimuler la croissance de certains micro-organismes et, à l'inverse, d'inhiber la croissance d'autres.
Média culturel doit contenir tous les éléments chimiques nécessaires aux micro-organismes cultivés sous une forme facilement assimilable et en quantités optimales. La source de carbone dans P. s. il existe généralement des glucides individuels, des sels d'acides organiques, ainsi que du carbone, qui fait partie des composés azotés (protéines, peptones, acides aminés, etc.). Les besoins en azote sont satisfaits s'il y a une protéine animale native dans les milieux (sang, sérum, liquide d'ascite, etc.), des peptones, des acides aminés, des sels d'ammonium et d'autres substances azotées (bases puriques et pyrimidiques, urée, etc.) . DANS milieux nutritifs rendre les sels minéraux nécessaires aux micro-organismes. Les microéléments nécessaires aux bactéries en quantités négligeables pénètrent généralement dans les milieux nutritifs soit avec de l'eau, qui est utilisée pour préparer le milieu, soit avec les matières premières qui font partie du milieu nutritif. Les facteurs de croissance pénètrent dans l'environnement avec divers dialysats, extraits et autolysats sous forme d'acides aminés, de peptides, de bases puriques et pyrimidiques et de vitamines.
Les matières premières protéinées utilisées pour la préparation des milieux de culture sont hydrolysées à l'aide de diverses enzymes (pepsine, trypsine, pancréatine, papaïne, protéases fongiques, etc.) ou acides (moins souvent des alcalis). L'hydrolyse a pour but de dissoudre et de décomposer la protéine avec formation de composés azotés assimilés par la cellule microbienne : peptones, polypeptides, acides aminés, qui font partie des hydrolysats ainsi obtenus. Pour satisfaire les besoins nutritionnels de chaque type spécifique de micro-organisme, on utilise ces ou ces hydrolysats, selon leur composition chimique, ou dans la composition de P. with. plusieurs hydrolysats sont introduits en même temps dans les proportions utilisées.
Conçu P. avec. dans sa composition et ses propriétés physico-chimiques, il doit correspondre aux conditions d'habitation naturelle des microorganismes. Les différences dans leurs besoins nutritionnels sont si diverses qu'elles excluent la possibilité de créer un P. universel avec. Par conséquent, les principes modernes de conception des supports sont basés sur une étude approfondie des besoins nutritionnels des micro-organismes.
Il est nécessaire que les milieux nutritifs contiennent non seulement les nutriments nécessaires aux microbes, mais qu'ils aient également une concentration optimale en ions hydrogène et hydroxyle. La plupart des micro-organismes pathogènes se développent mieux sur des milieux nutritifs avec une réaction légèrement alcaline (pH 7,2-7,4).Les exceptions sont Vibrio cholerae, dont la croissance optimale se situe dans la zone alcaline (pH 8,5-9,0) et l'agent causal de la tuberculose, qui nécessite une réaction faiblement acide (pH 6,2-6,8). Pour éviter un changement de pH lors de la culture de micro-organismes dans P. with. ajouter des tampons phosphates - un mélange de phosphates de potassium mono- et disubstitués, dont la concentration dans le milieu ne doit pas dépasser 0,5%.
Média culturel doit avoir une humidité suffisante et être isotonique pour la cellule microbienne, ce qui assure le déroulement normal des processus physiques et chimiques les plus importants. Pour la plupart des micro-organismes, l'environnement optimal est une solution de chlorure de sodium à 0,5 %. L'une des exigences essentielles des milieux de culture est leur stérilité, qui permet de cultiver des cultures pures de microbes.
Un rôle important dans la réception par page de P.. la bonne qualité appartient aux méthodes de leur contrôle. Pour les milieux nutritifs utilisés en production, le principal indicateur de qualité est l'efficacité du milieu (rendement), c'est-à-dire la capacité d'accumuler le maximum de biomasse de micro-organismes à pleines propriétés ou de produits de leur biosynthèse (toxines, etc.). Lors de l'évaluation des milieux nutritifs de diagnostic, le critère principal est l'indicateur de sensibilité - la capacité d'assurer la croissance des micro-organismes dans les dilutions maximales de la culture de l'agent pathogène. Selon le but des milieux nutritifs, lors de l'évaluation de leur qualité, d'autres indicateurs sont également utilisés - la stabilité des principales propriétés des micro-organismes cultivés et leur vitesse de croissance, la sévérité des propriétés de différenciation, etc.
Lors de la résolution des problèmes de qualité des milieux nutritifs, une importance importante est accordée à leur standardisation, qui est facilitée par la production de milieux sous forme de préparations sèches. En URSS, la production industrielle de milieux secs à des fins diverses a été établie: simple, sélective, diagnostique différentielle et spéciale.
Bibliographie: Yu.A. Kozlov Média culturel en microbiologie médicale, M., 1950, bibliogr.; Méthodes de recherche en laboratoire en clinique, éd. V.V. Menchikov, s. 315, 343, M., 1987 ; Meinell J. et Meinell E. Microbiologie expérimentale, trans. de l'anglais, p. 46, M., 1967 ; Méthodes de recherche microbiologique pour les maladies infectieuses, éd. G.Ya. Sinaï et O.G. Birger, s. 64, M., 1949 ; Entérobactéries, éd. DANS ET. Pokrovski, p. 258, M., 1985.
Attention! Article 'Média culturel'Est fourni à titre informatif uniquement et ne doit pas être utilisé pour l'automédication