Contenu
- 1 Organes en croissance à partir de cellules souches
- 1.1 Que sont les cellules souches ?
- 1.2 Quels organes et tissus les scientifiques ont-ils pu cultiver à l'aide de cellules souches ?
- 1.3 En 2005, des scientifiques américains ont développé pour la première fois des cellules cérébrales à part entière
- 1.4 En 2005, des scientifiques ont réussi à reproduire une cellule souche neurale
- 1.5 En 2006, des scientifiques suisses ont cultivé des valves cardiaques humaines à partir de cellules souches
- 1.6 En 2006, des scientifiques britanniques ont cultivé du tissu hépatique à partir de cellules souches
- 1.7 En 2006, un organe humain complexe - la vessie - a été cultivé pour la première fois aux États-Unis.
- 1.8 Des scientifiques américains ont réussi à faire pousser une vessie à part entière en laboratoire. Les cellules des patients eux-mêmes nécessitant une transplantation ont été utilisées comme matériel.
- 1.9 En 2007, les cellules souches ont aidé des scientifiques britanniques à créer une partie du cœur humain
- 1.10 En 2007, des scientifiques japonais ont cultivé la cornée de l'œil à partir de cellules souches
- 1.11 En 2007, des scientifiques japonais ont fait pousser une dent à partir de cellules souches
- 1.12 En 2008, des scientifiques américains ont réussi à faire pousser un nouveau cœur sur un squelette de l'ancien
- 2 Organes en croissance à partir de cellules souches
- 3 Nouvelle façon de cultiver des organes pour la transplantation (Vidéo)
- 4 État de l'art
- 4.1 Embryoïdes
- 4.2 Organoïdes du tissu cardiovasculaire
- 4.3 Organelles du foie
- 4.4 Organoïdes des glandes salivaires et lacrymales
- 4.5 Organelles rénales
- 4.6 Organites pancréatiques
- 4.7 Organelles de thym
- 4.8 Organites du tissu pulmonaire
- 4.9 Organites rétiniens
- 4.10 Organelles de l'épithélium sensoriel de l'oreille interne
- 4.11 Organelles de la prostate
- 4.12 Organites cérébraux
- 4.13 Entéroïdes épithéliaux, colonoïdes et cholangioides
- 4.14 Sphéroïdes du follicule pileux
- 4.15 Muscle de bio-ingénierie
- 4.16 Cartilage et tissu musculaire pour la chirurgie de reconstruction
- 4.17 Surmonter le rejet immunitaire des organes
- 4.18 Bio-impression 3D
- 5 Le rôle de l'auto-organisation des tissus
- 6 Rôle de la matrice extracellulaire
- 7 voir également
- 8 Remarques (modifier)
- 9 Littérature
Organes en croissance à partir de cellules souches
Avant de passer à l'histoire directe de la culture d'organes, je voudrais vous consacrer à ce que sont les cellules souches.
Que sont les cellules souches ?

Cellules souches - les progéniteurs de tous les types de cellules du corps, sans exception. Ils sont capables de s'auto-renouveler et, surtout, en se divisant, ils forment des cellules spécialisées de divers tissus. Les cellules souches renouvellent et remplacent les cellules perdues à la suite de tout dommage dans tous les organes et tissus. Ils sont conçus pour restaurer le corps humain dès sa naissance.
Avec l'âge, le nombre de cellules souches dans le corps diminue considérablement. Chez un nouveau-né, 1 cellule souche est trouvée sur 10 000, sur 20-25 ans - 1 sur 100 000, sur 30 - 1 sur 300 000. À l'âge de 50 ans, il ne reste que 1 cellule souche sur 500 000 dans le corps. L'épuisement des cellules souches dû au vieillissement ou à des maladies graves prive le corps de la capacité de se guérir. De ce fait, l'activité vitale de certains organes devient moins efficace.
Quels organes et tissus les scientifiques ont-ils pu cultiver à l'aide de cellules souches ?
Je ne cite que les exemples les plus célèbres de réalisations scientifiques.
en 2004, des scientifiques japonais ont développé pour la première fois au monde des vaisseaux sanguins capillaires structurellement complets à partir de cellules souches

Les scientifiques japonais ont été les premiers au monde à développer des vaisseaux sanguins capillaires structurellement complets à partir de cellules souches embryonnaires humaines. Cela a été rapporté le 26 mars 2004 par le journal japonais Yomiuri.
Selon la publication, un groupe de chercheurs de la faculté de médecine de l'Université de Kyoto dirigé par le professeur Kazuwa Nakao a utilisé des cellules capillaires générées à partir de cellules souches importées d'Australie en 2002. Jusqu'à présent, les chercheurs n'étaient capables de régénérer que les cellules nerveuses et les tissus musculaires, ce qui ne suffit pas à « produire » un organe entier. Informations du site
En 2005, des scientifiques américains ont développé pour la première fois des cellules cérébrales à part entière
Des scientifiques de l'Université de Floride (États-Unis) ont été les premiers au monde à cultiver des cellules cérébrales entièrement formées et greffées. Selon le chef de projet Bjorn Scheffler, les cellules ont été cultivées en « copiant » la régénération des cellules cérébrales. Les scientifiques espèrent maintenant cultiver des cellules pour la transplantation, ce qui pourrait aider à traiter la maladie d'Alzheimer et la maladie de Parkinson. processus de leur croissance du début à la fin. Informations du site Gazeta.ru basées sur des documents de l'Indépendant.
En 2005, des scientifiques ont réussi à reproduire une cellule souche neurale
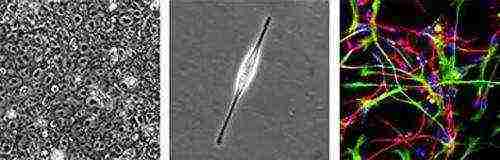
cellule souche nerveuse
Un groupe de scientifiques italo-britannique des universités d'Édimbourg et de Milan a appris à créer in vitro différents types de cellules du système nerveux à partir de cellules souches embryonnaires non spécialisées.
Les scientifiques ont appliqué des méthodes déjà développées de contrôle des cellules souches embryonnaires aux cellules souches neurales plus spécialisées qu'ils ont obtenues. Les résultats obtenus dans les cellules de souris ont été répliqués dans les cellules souches humaines. Dans une interview à la BBC, Stephen Pollard de l'Université d'Édimbourg a expliqué que le développement de ses collègues aiderait à recréer la maladie de Parkinson ou d'Alzheimer in vitro. Cela permettra de mieux comprendre le mécanisme de leur apparition et de leur développement, ainsi que de fournir aux pharmacologues un mini terrain d'essai pour trouver des traitements adaptés. Les négociations correspondantes avec les sociétés pharmaceutiques sont déjà en cours.
En 2006, des scientifiques suisses ont cultivé des valves cardiaques humaines à partir de cellules souches
À l'automne 2006, le Dr Simon Hoerstrap et ses collègues de l'Université de Zurich ont cultivé pour la première fois des valves cardiaques humaines à l'aide de cellules souches prélevées dans le liquide amniotique.
Cette réalisation pourrait permettre de développer des valves cardiaques spécifiquement pour l'enfant à naître si des malformations cardiaques sont trouvées dans l'utérus. Et peu de temps après la naissance, le bébé peut être transplanté avec de nouvelles valves.
Après la culture de la vessie et des vaisseaux sanguins à partir de cellules humaines en laboratoire, il s'agit de la prochaine étape vers la création de «propres» organes pour un patient particulier, capables d'éliminer le besoin de donneurs d'organes ou de mécanismes artificiels.
En 2006, des scientifiques britanniques ont cultivé du tissu hépatique à partir de cellules souches
À l'automne 2006, des scientifiques britanniques de l'Université de Newcastle ont annoncé qu'ils étaient les premiers au monde à cultiver un foie artificiel dans des conditions de laboratoire à partir de cellules souches prélevées sur le sang du cordon ombilical. La technique utilisée pour créer le mini-foie de 2 cm sera encore développée pour créer un foie fonctionnant normalement de taille standard.
En 2006, un organe humain complexe - la vessie - a été cultivé pour la première fois aux États-Unis.

Des scientifiques américains ont réussi à faire pousser une vessie à part entière en laboratoire. Les cellules des patients eux-mêmes nécessitant une transplantation ont été utilisées comme matériel.
« Avec une biopsie, on peut prélever un morceau de tissu, et au bout de deux mois, sa quantité va se multiplier plusieurs fois », explique le directeur de l'Institut de médecine régénérative Anthony Atala. "Nous mettons le matériau de départ et les substances spéciales sous une forme spéciale, les laissons dans un incubateur de laboratoire spécial et en quelques semaines nous obtenons un organe prêt à l'emploi qui peut déjà être transplanté." La première greffe a été réalisée à la fin des années 90. Une greffe de vessie a été réalisée chez sept patients. Les résultats ont répondu aux attentes des scientifiques, et maintenant les experts développent des méthodes pour créer 20 organes supplémentaires, parmi lesquels le cœur, le foie, les vaisseaux sanguins et le pancréas.
En 2007, les cellules souches ont aidé des scientifiques britanniques à créer une partie du cœur humain
Au printemps 2007, un groupe de scientifiques britanniques, composé de physiciens, biologistes, ingénieurs, pharmacologues, cytologistes et cliniciens expérimentés, dirigé par le professeur de chirurgie cardiaque Magdi Yakub, a réussi pour la première fois dans l'histoire à recréer l'un des types du tissu cardiaque humain à l'aide de cellules souches de moelle osseuse. Ce tissu agit comme des valves cardiaques. Si d'autres tests sont concluants, la technique développée peut être utilisée pour développer un cœur à part entière à partir de cellules souches en vue d'une transplantation aux patients.
En 2007, des scientifiques japonais ont cultivé la cornée de l'œil à partir de cellules souches
Au printemps 2007, lors d'un symposium sur la médecine de la reproduction dans la ville de Yokohama, les résultats d'une expérience unique menée par des spécialistes de l'Université de Tokyo ont été publiés. Les chercheurs ont utilisé une cellule souche prélevée sur le bord de la cornée. Ces cellules sont capables de se développer en divers tissus, remplissant des fonctions réparatrices dans le corps. La cellule isolée a été placée dans un milieu nutritif. Une semaine plus tard, il s'est développé en un groupe de cellules et, au cours de la quatrième semaine, il s'est transformé en une cornée d'un diamètre de 2 cm. De la même manière, une fine couche protectrice (conjonctive) a été obtenue, recouvrant la cornée de la à l'extérieur.
Les scientifiques soulignent que pour la première fois, un tissu humain à part entière a été cultivé à partir d'une seule cellule. La transplantation d'organes obtenus par une nouvelle méthode élimine le risque de transmission d'infections. Les scientifiques japonais ont l'intention de commencer les essais cliniques immédiatement après avoir été convaincus de la sécurité de la nouvelle technologie.
En 2007, des scientifiques japonais ont fait pousser une dent à partir de cellules souches
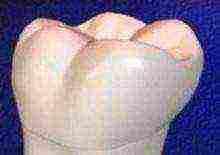
Des scientifiques japonais ont réussi à faire pousser une dent à partir d'une seule cellule. Il a été cultivé en laboratoire et transplanté sur des souris. Le matériel cellulaire a été injecté dans l'échafaudage de collagène. Après la culture, il s'est avéré que la dent a pris une forme mature, composée de parties complètes telles que la dentine, la pulpe, les vaisseaux, les tissus parodontaux et l'émail. Selon les chercheurs, la dent était identique à la dent naturelle. Après la transplantation d'une dent de souris de laboratoire, elle s'est greffée et a fonctionné tout à fait normalement. La technique permettra de faire croître des organes entiers à partir d'une ou deux cellules, selon les chercheurs.
En 2008, des scientifiques américains ont réussi à faire pousser un nouveau cœur sur un squelette de l'ancien
Doris Taylor et ses collègues de l'Université du Minnesota ont créé un cœur de rat vivant en utilisant une technique inhabituelle. Les scientifiques ont pris un cœur de rat adulte et l'ont placé dans une solution spéciale qui a éliminé toutes les cellules du tissu musculaire cardiaque du cœur, laissant les autres tissus intacts. Cet échafaudage purifié a été ensemencé avec des cellules de muscle cardiaque d'un rat nouveau-né et placé dans un environnement qui imite les conditions dans le corps.
Après seulement quatre jours, les cellules se sont tellement multipliées que de nouveaux tissus ont commencé à se contracter, et après huit jours, le cœur reconstruit était déjà capable de pomper le sang, bien qu'à un niveau de puissance de seulement 2% (en partant d'un cœur adulte en bonne santé). Ainsi, les scientifiques ont obtenu un organe fonctionnel à partir des cellules du deuxième animal. De cette façon, à l'avenir, il serait possible de traiter les cœurs prélevés pour transplantation afin d'exclure le rejet d'organe. "Vous pouvez faire n'importe quel organe comme celui-ci: rein, foie, poumon, pancréas", explique Taylor. L'échafaudage du donneur, qui détermine la forme et la structure de l'organe, sera rempli de cellules spécialisées fabriquées à partir de cellules souches natives du patient.
Il est curieux que dans le cas d'un cœur, vous puissiez essayer de prendre comme base un cœur de porc, anatomiquement proche d'un humain. En supprimant uniquement le tissu musculaire, d'autres tissus d'un tel organe peuvent déjà être complétés par des cellules de muscle cardiaque humain cultivées, obtenant ainsi un organe hybride qui, en théorie, devrait bien s'enraciner. Et les nouvelles cellules seront immédiatement bien approvisionnées en oxygène - grâce aux anciens vaisseaux et capillaires laissés par le cœur du donneur.
Killere 28/01/2009

Scientifique médical au travail
Pendant de nombreuses années, les scientifiques du monde entier ont travaillé pour créer des tissus et des organes fonctionnels à partir de cellules. La pratique la plus courante est la culture de nouveaux tissus à partir de cellules souches. Cette technologie a été testée pendant de nombreuses années et a toujours été couronnée de succès.Mais il n'est pas encore possible de fournir entièrement le nombre d'organes requis, car il est possible de cultiver un organe pour un patient particulier uniquement à partir de ses cellules souches.
Des scientifiques de Grande-Bretagne ont réussi ce que personne n'a pu faire jusqu'à présent - reprogrammer les cages et en faire un organe fonctionnel. Cela permettra dans un avenir prévisible de fournir des organes à transplanter à tous ceux qui en auront besoin.
Organes en croissance à partir de cellules souches
La culture d'organes à partir de cellules souches est connue des médecins depuis longtemps. Les cellules souches sont les progéniteurs de toutes les cellules du corps. Ils peuvent remplacer toutes les cellules endommagées et sont destinés à restaurer le corps. Le nombre maximal de ces cellules se produit chez les enfants après la naissance et leur nombre diminue avec l'âge. Par conséquent, la capacité du corps à se guérir diminue progressivement.
 Fabriquer des organes à partir de cellules est un processus complexe et coûteux
Fabriquer des organes à partir de cellules est un processus complexe et coûteux
De nombreux organes pleinement fonctionnels à partir de cellules souches ont déjà été créés dans le monde, par exemple, en 2004, au Japon, des capillaires et des vaisseaux sanguins ont été créés à partir d'eux. Et en 2005, des scientifiques américains ont réussi à créer des cellules cérébrales. En 2006, des valves cardiaques humaines à partir de cellules souches ont été créées en Suisse. Dans le même 2006, du tissu hépatique a été créé en Grande-Bretagne. Jusqu'à présent, les scientifiques ont traité presque tous les tissus du corps, même les dents qui ont poussé.
Une expérience très curieuse a été menée aux États-Unis - un nouveau cœur y a été cultivé sur un cadre de l'ancien. Le cœur du donneur a été débarrassé de ses muscles et de nouveaux muscles ont été construits à partir de cellules souches. Cela exclut complètement la possibilité de rejet de l'organe donneur, car il devient « le sien ». Soit dit en passant, il est suggéré que comme cadre, il sera possible d'utiliser un cœur de porc, qui est anatomiquement très similaire à un humain.
Nouvelle façon de cultiver des organes pour la transplantation (Vidéo)
Le principal inconvénient de la méthode existante de culture d'organes est la nécessité de leur production des propres cellules souches du patient. Tous les patients ne peuvent pas prendre de cellules souches, et plus encore, tout le monde n'a pas de cellules congelées prêtes à l'emploi. Mais récemment etDes chercheurs de l'Université d'Édimbourg ont pu reprogrammer les cellules du corps afin qu'elles puissent développer les organes nécessaires à partir d'elles. Selon les prévisions, l'utilisation généralisée de cette technologie deviendra possible dans une dizaine d'années.
À ce jour, les scientifiques ont déjà réussi à créer une glande thymus pleinement fonctionnelle, qui régule le système immunitaire et est située à côté du cœur. Cet organe était fabriqué à partir de cellules de tissu conjonctif de mil, obtenu à partir d'un embryon de souris. Les cellules du tissu conjonctif ont été transplantées dans une autre culture cellulaire grâce à un "commutateur génétique" spécial dans l'ADN.
Jusqu'à présent, les expériences sur la culture d'organes de cette manière n'ont pas donné de résultats tangibles. Il s'agit de la première expérience réussie qui a montré qu'il est possible de cultiver l'organe souhaité même sans utiliser de cellules souches, mais avec l'aide de toutes les autres cellules du corps, par exemple, les cellules des tissus conjonctifs.
Bonjour! Je suis Alice. Que puis-je dire sur moi-même ? Adhérent à un mode de vie sain.
Organes en croissance - une technologie de bio-ingénierie prometteuse, dont le but est de créer divers organes biologiques viables à part entière pour l'homme. Actuellement, la technologie n'est pas utilisée chez l'homme, car toutes les tentatives de transplantation de tels organes ont échoué. Cependant, il existe des développements et des expériences actifs dans ce domaine. À l'aide de cultures cellulaires tridimensionnelles, les scientifiques ont appris à cultiver les « rudiments » d'organes appelés organites (Anglais... organoïde, à ne pas confondre avec les organites).Ces organites sont utilisés par les scientifiques pour étudier et modéliser l'organogenèse, modéliser des tumeurs et diverses maladies pouvant affecter certains organes, tester et dépister divers médicaments et substances toxiques sur les organoïdes, ainsi que pour des expériences sur le remplacement d'organes ou le traitement d'organes endommagés par des greffes.
État de l'art
L'idée de faire croître artificiellement des organes humains est apparue au milieu du 20e siècle, à partir du moment où les organes de donneurs ont commencé à être transplantés chez l'homme. Même avec la possibilité de transplanter la plupart des organes aux patients, la question du don est actuellement très aiguë. Un grand nombre de patients meurent sans attendre leur organe. La croissance artificielle d'organes pourrait, en théorie, sauver des millions de vies humaines. Certaines avancées dans ce sens ont déjà été réalisées à l'aide de méthodes de médecine régénérative.
Embryoïdes
Les embryoïdes ou corps embryonnaires sont des agrégats tridimensionnels de cellules, où sont présentées les cellules des trois couches germinales, qui sont nécessaires à la formation des organes et des tissus du corps. Dans des conditions de laboratoire, ils peuvent être obtenus par diverses méthodes de culture à partir d'iPSC indifférenciées. La formation de corps embryonnaire est une méthode couramment utilisée pour différencier les iPSC en diverses lignées cellulaires.
Organoïdes du tissu cardiovasculaire
En cultivant des embryoïdes sur des hydrogels conjugués au collagène avec une rigidité similaire à celle du tissu musculaire cardiaque, Shkumatov et al. réussi à obtenir des organites cardiovasculaires capables de se contracter. Ainsi, ils ont montré que la rigidité de la matrice extracellulaire peut jouer un rôle important dans la différenciation cellulaire. La nécessité de créer des contraintes mécaniques confortables pour les cellules cultivées en régulant la rigidité du matériau substrat pour la culture a été notée dans un certain nombre d'autres travaux. Les nouvelles technologies ont permis de synchroniser les contractions des cellules de l'organoïde cardiaque. Un rythme de stimulation électrique correctement sélectionné, forçant le tissu musculaire en croissance à se contracter, permet non seulement de raccourcir le temps de culture, mais également de copier de manière plus qualitative le tissu cardiaque sain mature dans un certain nombre de paramètres.
Organelles du foie
Des chercheurs japonais ont franchi une étape importante vers la culture d'organes en laboratoire. Ils ont réussi à créer un foie humain simple mais entièrement fonctionnel. Les chercheurs ont obtenu des cellules hépatiques à partir d'iPSC et les ont cultivées avec des cellules endothéliales (précurseurs des vaisseaux sanguins) et des cellules mésenchymateuses, qui agissent comme la "colle" qui unit différentes cellules. Il s'est avéré qu'à un certain rapport de ces cellules, leur culture conjointe présente la capacité de s'auto-organiser et forme des structures sphériques tridimensionnelles qui représentent le rudiment du foie. Lorsque ces bourgeons hépatiques ont été transplantés dans des souris, il a été constaté qu'en environ 48 heures, ils forment des liaisons avec les vaisseaux sanguins voisins et sont capables de remplir des fonctions caractéristiques du foie. Selon certains scientifiques, de tels rudiments du foie, s'ils sont réduits en taille puis introduits dans la circulation sanguine du foie endommagé, pourraient aider à normaliser sa fonction. Malheureusement, il n'y a toujours aucune garantie que les cellules hépatiques dérivées des iPSC n'induisent pas la formation de tumeurs. Un raffinement minutieux de ces méthodes est nécessaire. Sur la base des organites hépatiques, un dispositif a été créé - un foie bio-artificiel avec des organites hépatiques pour le maintien temporaire de la vie des patients.
Takebe et al. a créé une méthode reproductible pour la culture à grande échelle d'organites de foie humain vascularisé entièrement à partir de cellules souches pluripotentes induites (iPSCs) et a démontré leur fonctionnalité pour une utilisation en tant que greffe pour le traitement des humains.
Organoïdes des glandes salivaires et lacrymales
Une équipe de chercheurs de l'Université des sciences et de la société de Tokyo Technologies d'organes inc dirigé par le professeur Takashi Tsuji (Takashi tsuji) a démontré la régénération fonctionnelle des glandes salivaires sous-maxillaires à partir d'embryons de glandes salivaires issus de la bio-ingénierie après leur transplantation orthotopique (avec ablation de la glande défectueuse), dans le but d'une thérapie réparatrice en remplaçant l'organe chez la souris dans lequel le défaut des glandes salivaires a été modélisé . L'embryon créé par génie biologique s'est développé en une glande mature par la formation de processus uviformes avec l'épithélium et l'innervation musculaires. Il produisait et sécrétait de la salive en réponse à une stimulation du goût avec du citrate, rétablissait le processus d'ingestion des aliments et protégeait la cavité buccale des infections bactériennes. Le même groupe a réalisé avec succès une transplantation orthotopique d'embryons issus de la bio-ingénierie des glandes lacrymales chez des souris avec un modèle simulant des dommages à l'épithélium cornéen causés par un dysfonctionnement de la glande lacrymale. In vivo, les embryons issus du génie biologique ont donné naissance à des glandes lacrymales capables de remplir des fonctions physiologiques, notamment la production de larmes en réponse à la stimulation nerveuse et la protection de la surface oculaire.
Organelles rénales
Des technologies ont été développées pour cultiver des organites rénaux à partir de cellules pluripotentes, qui peuvent être utilisées pour simuler des maladies rénales et cribler des médicaments pour leur traitement, et à l'avenir pour implanter des reins miniatures chez des patients créés à partir de leurs propres iPSC. Une stratégie a été développée pour la transplantation d'un tel organoïde, qui lui permet de drainer l'urine sécrétée par celui-ci dans la vessie.
Organites pancréatiques
Des chercheurs du Danish Stem Cell Center ont développé une culture sur gel tridimensionnelle (3-D) Matrigel avec une composition spécialement sélectionnée du milieu, qui peut être utilisé pour faire pousser des "graines" de pancréas miniatures. A long terme, de tels "cadres" peuvent être utiles à la lutte contre le diabète en tant que "pièces détachées".
Organelles de thym
Le thymus joue un rôle important dans la génération de nouvelles cellules T. Cette glande est très active au début de la vie, mais meurt à l'âge adulte dans un processus connu sous le nom d'involution thymique, entraînant une diminution de l'immunité chez les personnes âgées. L'injection d'organites de thymus dans le corps des personnes âgées pourrait les aider à combattre un certain nombre de maladies séniles. Des expériences sur la culture d'organoïdes de thymus et leur transplantation dans des souris athymiques donnent de l'espoir à cet égard. Il s'est avéré que les organites du thymus sont non seulement capables de s'enraciner, mais peuvent également contribuer efficacement à la restauration de la fonction thymique chez ses destinataires. À l'avenir, les organoïdes thymiques permettront de produire des cellules T modifiées dans des bioréacteurs pour la lutte ciblée contre le cancer.
Organites du tissu pulmonaire
En influençant les voies de signalisation des iPSC humaines, il a été possible d'obtenir des organites des poumons humains constitués de compartiments pulmonaires épithéliaux et mésenchymateux, avec des caractéristiques structurelles caractéristiques des tissus pulmonaires. Une modification de cette méthode permet de cultiver des organites de tissu pulmonaire dans un bioréacteur et de les utiliser pour étudier les maladies pulmonaires.
Organites rétiniens
Développement d'organites 3-D du globe oculaire et de la rétine avec des cellules photoréceptrices : bâtonnets et cônes. Cela permettra à l'avenir de développer des méthodes de traitement des maladies oculaires telles que la dégénérescence rétinienne.
Organelles de l'épithélium sensoriel de l'oreille interne
Une technologie similaire a été utilisée pour développer des méthodes d'obtention d'organites dans l'épithélium sensoriel de l'oreille interne, qui permettront à l'avenir de lutter contre la surdité.
Organelles de la prostate
Les organoïdes de la prostate ont été obtenus par différenciation dirigée des CSE. Il est à noter que le temps d'exposition aux facteurs WNT10B/Fgf10, qui jouent un rôle clé dans la formation de la prostate, ainsi que lors du développement intra-utérin, est d'une importance décisive pour la formation des cellules épithéliales de la prostate.
Organites cérébraux
À des fins de modélisation et de recherche in vitro du cerveau humain et de ses maladies, une culture tridimensionnelle d'organites de cellules cérébrales obtenues à partir de cellules souches pluripotentes a été créée. Organites cérébraux (Anglais... Cerebral organoid) peut être utilisé pour étudier la neurulation et d'autres processus de neurogenèse, en tant que modèles simples de tissu cérébral complexe pour étudier les effets des toxines et des médicaments sur le tissu cérébral grâce à leur dépistage initial sûr et économique, ainsi que pour obtenir des échantillons pour la xénotransplantation.
Entéroïdes épithéliaux, colonoïdes et cholangioides
Lors de la modélisation des organes épithéliaux, le problème est la variété des sources de tissus épithéliaux, l'extrême sensibilité de l'activité proliférative des cellules épithéliales aux changements externes, ainsi que les caractéristiques associées à la transition épithéliale-mésenchymateuse qui sont caractéristiques exclusivement des tissus épithéliaux. La forme de ces tissus étant principalement une paroi, sa restauration est associée à une organisation et à une fonctionnalité multicouches (péristaltisme, régulation nerveuse). Ces caractéristiques de la morphologie tissulaire résument les problèmes biologiques posés par la recherche de nouvelles méthodes efficaces de chirurgie reconstructive et régénérative des parois des organes creux épithéliaux (œsophage, estomac, intestins), ainsi que des structures tubulaires (voie biliaire, uretère). Les organelles obtenues à partir de cellules épithéliales de l'intestin grêle et du gros intestin aideront à l'étude de l'intestin humain. Ils peuvent être utilisés pour étudier les cellules souches intestinales et les mécanismes d'altération des fonctions physiologiques du tractus gastro-intestinal, ainsi que pour créer des organites tumoraux pour l'étude du cancer et le dépistage de médicaments.
Sphéroïdes du follicule pileux
La technique de croissance de cellules sous forme de sphéroïdes dans une goutte pendante a été utilisée pour cultiver des cellules de la couche papillaire des follicules pileux humains. Il a été démontré que lorsque ces cellules sont cultivées sous forme de sphéroïdes, lorsque les cellules se développent dans un environnement tridimensionnel plus naturel et interagissent les unes avec les autres, elles sont capables de réinduire la formation de follicules pileux dans la peau humaine.
Muscle de bio-ingénierie
Le tissu dit "musculaire" a été créé qui répond aux signaux du nerf grâce à la jonction neuromusculaire issue des cellules musculaires et des cellules neuronales. Ce tissu peut potentiellement être utilisé pour des analyses pharmacocinétiques et pour créer un entraînement musculaire pour les biorobots et les prothèses. De plus, cultivé in vitro Le muscle issu de la bio-ingénierie s'est avéré capable de se développer, de se régénérer et a pu s'enraciner après sa transplantation dans un animal. Une technologie a été développée pour obtenir des muscles à partir des iPSCs, qui peuvent être multipliés à l'infini par culture, ce qui permettra de faire croître du tissu musculaire en grande quantité
Cartilage et tissu musculaire pour les opérations de reconstruction
À partir d'un petit nombre de cellules dans la cloison nasale des patients, il a été possible de faire croître du tissu cartilagineux, qui a été utilisé pour la reconstruction du nez après l'ablation de la tumeur. Après plus d'un an, tous les patients étaient satisfaits des résultats esthétiques et fonctionnels de l'opération et aucun effet négatif n'a été enregistré.
Les implants tissulaires, cultivés en laboratoire à partir des propres cellules musculaires et épithéliales de patientes qui avaient besoin d'une intervention chirurgicale pour reconstruire le vagin, ont non seulement pris racine avec succès et fonctionné après la chirurgie plastique.
Un substrat et un incubateur spécial pour la croissance de l'œsophage humain à partir de cellules de patients ont été créés. À long terme, cette évolution sauvera la vie des nouveau-nés nés sans une partie importante de l'œsophage.
Surmonter le rejet immunitaire des organes
Un obstacle important à la transplantation de tissus et d'organes est leur rejet. Même si l'allogreffe réussit, le patient transplanté doit généralement prendre des médicaments anti-rejet pour le reste de sa vie.Pour rendre le greffon « invisible » pour le système immunitaire humain, une culture de cellules souches embryonnaires humaines a été créée qui synthétise deux molécules qui suppriment l'activité des cellules T, à savoir CTLA4-Ig (Antigène-4-immunoglobuline associé aux lymphocytes T cytotoxiques) et PD-L1 (Ligand mort programmé 1), avant et après différenciation. Une caractéristique de ces cellules est que les tissus allogéniques (provenant d'une autre personne) qui en sont formés ne provoquent pas de réaction immunitaire et de rejet après la transplantation. Cela signifie que la transplantation d'organes et de tissus cultivés à partir de ces cellules "universelles" peut être possible sans qu'il soit nécessaire de vérifier la compatibilité.
Bio-impression 3D
3D Bioprinting Solutions a été le premier au monde à créer une glande thyroïde de souris fonctionnelle à l'aide de la bioimpression 3D. Le bioprinter russe FABION a été utilisé pour imprimer la glande thyroïde à partir de cellules prélevées sur des souris. Les organes imprimés ont été transplantés chez des souris dont la glande thyroïde a été détruite avec de l'iode radioactif. Les résultats des travaux ont été présentés par les auteurs lors de diverses conférences scientifiques et publiés dans des revues à comité de lecture pour les spécialistes.
Le rôle de l'auto-organisation des tissus
Voir aussi Morphogenèse synthétique
Les scientifiques ne peuvent toujours pas expliquer comment les cellules s'auto-organisent en tissus complexes. Les structures ordonnées proviennent de cellules sans forces ou influences externes. Tout au long du développement, les cellules s'influencent mutuellement et prennent des décisions basées sur des « conversations » avec leurs voisins. Selon un scientifique japonais Sasaï« De tels phénomènes d'auto-organisation ne peuvent être observés que dans des groupes d'environ 1 000 à 100 000 cellules. A ce niveau, les cellules peuvent être directement démocratiques ; elles n'ont pas besoin d'un gouverneur ou d'un président spécial pour les organiser. » Les cellules sont « triées » : le même type se collent, tandis que les différents types restent déconnectés. Plus tard, apparaissent des centres d'organisation qui guident la morphogenèse en isolant des facteurs de croissance (morphogènes) à l'aide de gradients, dont les concentrations créent ce que l'on appelle les biochamps. Un exemple d'application pratique des gradients de concentration est la croissance induite d'axones le long des gradients de concentration de cytokines spécifiques.
Le processus d'auto-organisation de la culture cellulaire en organites peut être contrôlé en sélectionnant les composants nécessaires de l'environnement 3D. Il est important de noter que les mêmes organites peuvent être obtenus en utilisant différents milieux. Il est seulement important de donner le bon signal de "démarrage", et le mécanisme d'auto-organisation fera le reste.
Rôle de la matrice extracellulaire
Pour le fonctionnement normal et le renouvellement des cellules tissulaires de l'organisme, une matrice intercellulaire est nécessaire, qui crée, maintient et régule les conditions de leur existence dans une niche. La matrice extracellulaire est un système multifonctionnel qui participe activement à une variété de processus associés au développement du corps, jouant souvent le rôle d'un "indice" qui guide la différenciation des cellules dans un sens ou dans un autre. Les composants de la matrice peuvent être divisés en deux groupes conditionnels : les protéines structurelles, telles que les protéines fibrillaires et les glycosaminoglycanes, et les protéines régulatrices, y compris toutes sortes de facteurs de croissance, les protéines cellulaires de la matrice (protéines de la famille CCN, IGFBP, décorine et biglycane) , des enzymes (métalloprotéinases) et des récepteurs (intégrines). Il n'est pas encore possible de recréer un système d'organes et une architecture aussi complexes par des moyens artificiels, par exemple, en utilisant la bio-impression 3D. Cependant, les scientifiques ont développé des technologies permettant d'obtenir une matrice extracellulaire à partir d'allogreffes d'organes donneurs en les lavant avec des solutions de détergents, au cours desquelles les cellules donneuses sont retirées et il ne reste que la matrice acellulaire, qui conserve encore l'architecture (notamment le réseau de les vaisseaux sanguins et lymphatiques et la matrice du tissu nerveux), ainsi que la plupart des protéines régulatrices. Ensuite, cette matrice est ensemencée avec les cellules du receveur et placée dans un bioréacteur, et diverses technologies de colonisation matricielle et de sa culture peuvent être utilisées, y compris combinées : par exemple, la bio-impression 3D, la culture statique et dynamique.De ce fait, il est possible de faire pousser une autogreffe, qui est constituée des cellules du receveur et, en théorie, ne doit pas être rejetée par son système immunitaire. Cette technologie permet à la matrice acellulaire obtenue à partir du cœur du donneur d'être peuplée de cardiomyocytes obtenus à partir de l'iPSC du receveur et de développer à partir d'eux un muscle cardiaque fonctionnel dans un incubateur qui leur fournit une solution nutritive, et reproduit également certains paramètres de la l'environnement de l'organisme vivant.
Une prothèse trachéale a été développée, composée à 95% de tissus du patient, ce qui évite le rejet d'organe. Le squelette de la prothèse est constitué d'os provenant de tissu périosté. La surface interne de l'organe a été créée à partir de cellules souches et de la propre muqueuse du patient. Le bioréacteur, dans lequel la nouvelle trachée a mûri pendant six mois, était le tissu de la paroi thoracique du patient. À la suite de l'incubation dans la prothèse, son propre système vasculaire s'est formé.
voir également
- Autogreffe
- Dents qui poussent
- Cultiver du thymus à partir des iPSC
- Décellularisation
- Cultiver des organes et des tissus humains chez les animaux
- Morphogenèse synthétique
- Bio-impression 3D
Remarques (modifier)
- ↑ Des chirurgiens de premier plan mettent en garde contre le battage médiatique au sujet de la régénération trachéale. Consulté le 2 juillet 2017.
- ↑ Cantrell MA, juge en chef Kuo (2015). Modélisation organoïde pour la médecine de précision contre le cancer. Génome Med.; 7 (1) : 32. DOI : 10.1186 / s13073-015-0158-y.PMID 25825593
- ↑ Lancaster MA, Knoblich JA (2014). Génération d'organoïdes cérébraux à partir de cellules souches pluripotentes humaines. Nat Protoc.; 9 (10) : 2329-40. DOI : 10.1038 / nprot.2014.158. PMID
- ↑ Habka D, Mann D, Landes R, Soto-Gutierrez A (2015) Future Economics of Liver Transplantation: A 20 Year Cost Modelling Forecast and the Prospect of Bioengineering Autologous Liver Grafts. PLoS ONE 10 (7) : e0131764. doi: 10.1371 / journal.pone.0131764
- ↑ Steven D. Sheridan, Vasudha Surampudi, Raj R. Rao, (2012). Analysis of Embryoid Bodies Derived from Human Induced Pluripotent Stem Cells as a Means to Assess Pluripotency, Stem Cells International, 2012, Article ID 738910,
- ↑ Toni-Marie Achilli, Julia Meyer, Jeffrey R Morgan, (2012). Avancées dans la formation, l'utilisation et la compréhension des sphéroïdes multicellulaires, Expert Opinion on Biological Therapy, 12 (10), 1347-1360 DOI: 10.1517 / 14712598.2012.707181
- ↑ Carpenedo RL, Sargent CY, McDevitt TC (2007) La culture en suspension rotative améliore l'efficacité, le rendement et l'homogénéité de la différenciation des corps embryoïdes. Cellules souches 25 : 2224-2234. DOI : 10.1634/cellules souches.2006-0523
- ↑ Shkumatov A, Baek K, Kong H (2014) Formation d'organoïdes cardiovasculaires modulés par la rigidité matricielle à partir de corps embryonnaires. PLoS ONE 9 (4) : e94764. Doi : 10.1371 / journal.pone.0094764
- ↑ Heras-Bautista, C. O., Katsen-Globa, A., Schloerer, N. E., Dieluweit, S., El Aziz, O. M. A., Peinkofer, G., ... & Pfannkuche, K. (2014). L'influence des conditions physiologiques matricielles sur la culture permanente de cardiomyocytes dérivés de cellules souches pluripotentes induites. Biomatériaux, 35 (26), 7374-7385.
- ↑ Qiu, Y., Bayomy, A.F., Gomez, M.V., Bauer, M., Du, P., Yang, Y., ... & Liao, R. (2015). Un rôle pour la rigidité de la matrice dans la régulation de la fonction cellulaire de la population cardiaque. American Journal of Physiology-Heart and Circulatory Physiology, 308 (9), H990-H997. DOI : 10.1152 / ajpheart.00935.2014
- ↑ Patel, A. K., Celiz, A. D., Rajamohan, D., Anderson, D. G., Langer, R., Davies, M. C., ... & Denning, C. (2015). Un substrat synthétique défini pour la culture sans sérum de cardiomyocytes dérivés de cellules souches humaines avec une maturité fonctionnelle améliorée identifiée à l'aide de microréseaux de matériaux combinatoires. Biomatériaux. 61, 257-265. DOI : 10.1016 / j.biomatériaux.2015.05.019
- ↑ Le petit cœur battant issu de CELLULES SOUCHES, Courrier en ligne... Consulté le 2 juillet 2017.
- ↑ Questions de cœur : des chercheurs créent un cœur battant en 3D (eng.), ScienceQuotidien... Consulté le 2 juillet 2017.
- ↑ Anatoli Glyantsev (2018). Pour la première fois, du tissu cardiaque mature a été cultivé à partir de cellules souches. "Vesti.Nauka" ()
- ↑ Ronaldson-Bouchard, K., Ma, S. P., Yeager, K., Chen, T., Song, L., Sirabella, D., ... & Vunjak-Novakovic, G. (2018). Maturation avancée du tissu cardiaque humain cultivé à partir de cellules souches pluripotentes. Nature, 556, 239-243 DOI : 10.1038 / s41586-018-0016-3
- ↑ Takanori Takebe, Keisuke Sekine, Masahiro Enomura et al. & Hideki Taniguchi (2013) Foie humain vascularisé et fonctionnel issu d'une greffe de bourgeon d'organe dérivé d'iPSC. Nature DOI : 10.1038 / nature12271
- ↑ Foie humain élevé chez la souris
- ↑ Huch, M; Gehart, H; Van Boxtel, R; Hamer, K; Blokzijl, F; Verstegen, M.M.; Ellis, E; Van Wenum, M; Fuchs, S.A.; De Ligt, J; Van De Wetering, M; Sasaki, N; Boers, S.J.; Kemperman, H; De Jonge, J; Ijzermans, J.N.; Nieuwenhuis, E.E.; Hoekstra, R; Strom, S ; Vries, R.R.; Van Der Laan, L.J.; Cuppen, E ; Clevers, H (2015). Culture à long terme de cellules souches bipotentes stables du génome de foie humain adulte. Cellule 160 (1-2) : 299-312. DOI : 10.1016 / j.cell.2014.11.050. PMC 4313365. PMID 25533785.
- ↑ Des chercheurs testent un dispositif hépatique bioartificiel pour traiter l'insuffisance hépatique aiguë (eng.), ScienceQuotidien... Consulté le 2 juillet 2017.
- ↑ Takebe T. et al., & Taniguchi H. (2017). Production massive et reproductible de bourgeons hépatiques entièrement à partir de cellules souches pluripotentes humaines. Cell Reports, 21 (10), 2661-2670. DOI : 10.1016 / j.celrep.2017.11.005
- ↑ Ogawa, M., Oshima, M., Imamura, A., et al. & Tsuji, T. (2013) Régénération fonctionnelle des glandes salivaires par transplantation d'un germe d'organe génétiquement modifié. Communications naturelles ; 4, numéro d'article : 2498 DOI : 10.1038 / ncomms3498
- ↑ Hirayama, M., Ogawa, M., Oshima, M., et al. & Tsuji, T. (2013) Régénération fonctionnelle des glandes lacrymales par transplantation d'un germe d'organe modifié par génie biologique. Nature Communications, 4, Numéro d'article : 2497 DOI : 10.1038 / ncomms3497
- ↑ Little, M. H., & Takasato, M. (2015). Génération d'un rein auto-organisé à partir de cellules pluripotentes. Opinion actuelle en transplantation d'organes, 20 (2), 178-186. DOI : 10.1097 / MOT.000000000000174
- ↑ Minoru Takasato, Pei X. Er, Han S. Chiu, et al., & Melissa H. Little (2015). Les organoïdes rénaux des cellules iPS humaines contiennent plusieurs lignées et modèlent la néphrogenèse humaine. Nature, DOI : 10.1038 / nature15695
- ↑ Yokote, S., Matsunari, H., Iwai, S., Yamanaka, S., Uchikura, A., Fujimoto, E., ... & Yokoo, T. (2015). Stratégie d'excrétion urinaire pour les reins embryonnaires générés par des cellules souches. Actes de l'Académie nationale des sciences, 201507803. DOI : 10.1073/pnas.1507803112
- ↑ Greggio, C., De Franceschi, F., Figueiredo-Larsen, M., Gobaa, S., Ranga, A., Semb, H., ... & Grapin-Botton, A. (2013) Artificielle tridimensionnelle les niches déconstruisent le développement du pancréas in vitro. Développement, 140 (21), 4452-4462. doi: 10.1242 / dev.096628
- ↑ Fan, Y., Tajima, A., Goh, S. K., Geng, X., Gualtierotti, G., Grupillo, M., ... & Trucco, M. (2015). Bio-ingénierie des organoïdes du thymus pour restaurer la fonction thymique et induire une tolérance immunitaire spécifique du donneur aux allogreffes. Thérapie moléculaire. DOI : 10.1038 / mt.2015.77
- ↑ Le thymus artificiel peut produire des cellules T anticancéreuses à partir de cellules souches sanguines. Consulté le 2 juillet 2017.
- ↑ Christopher S Seet, et al., & Amélie Montel-Hagen (2017). Génération de cellules T matures à partir de cellules souches et progénitrices hématopoïétiques humaines dans des organoïdes thymiques artificiels. Méthodes Nature DOI : 10.1038 / nmeth.4237
- ↑ Dye, B.R., Hill, D.R., Ferguson, M.A., Tsai, Y.H., Nagy, M.S., Dyal, R., ... & Spence, J.R. (2015). Génération in vitro d'organoïdes pulmonaires dérivés de cellules souches pluripotentes humaines. Elife, 4, e05098. EST CE QUE JE:
- ↑ Dan C. Wilkinson, Jackelyn A. Alva-Ornelas, Jennifer M.S. Sucre et al., & Brigitte N. Gomperts (2016). Développement d'une technologie de bio-ingénierie tridimensionnelle pour générer du tissu pulmonaire pour la modélisation personnalisée de la maladie. Cellules souches Trans Med. DOI : 10.5966 / sctm.2016-0192
- ↑ Eiraku, M., Takata, N., Ishibashi, H., Kawada, M., Sakakura, E., Okuda, S., ... & Sasai, Y. (2011). Morphogenèse auto-organisée de la coupe optique en culture tridimensionnelle. Nature, 472 (7341), 51-56.
- ↑ « mini-rétines » 3-D cultivées à partir de cellules souches de souris et humaines (eng.), ScienceQuotidien... Consulté le 2 juillet 2017.
- ↑ Manuela Völkner et autres & Mike O. Karl (2016). Les organoïdes rétiniens des cellules souches pluripotentes récapitulent efficacement la rétinogenèse. Rapports sur les cellules souches DOI :
- ↑ Longworth-Mills, E., Koehler, K. R. et Hashino, E. (2015). Génération d'organoïdes de l'oreille interne à partir de cellules souches embryonnaires de souris. Méthodes en biologie moléculaire, 10, 7651 DOI : 10.1007 / 7651_2015_215
- ↑ Calderon-Gierszal EL, Prins GS (2015) a dirigé la différenciation des cellules souches embryonnaires humaines en organoïdes de la prostate in vitro et sa perturbation par une exposition au bisphénol A à faible dose. PLoS ONE 10 (7) : e0133238. Doi : 10.1371 / journal.pone.0133238
- ↑ Lancaster, M.A., Renner, M., Martin, C.A., Wenzel, D., Bicknell, L.S., Hurles, M.E., ... & Knoblich, J.A. (2013). Les organoïdes cérébraux modélisent le développement du cerveau humain et la microcéphalie. Nature, 501 (7467), 373-379.
- ↑ Smith, I., Silveirinha, V., Stein, J. L., Torre-Ubieta, L., Farrimond, J. A., Williamson, E. M. et Whalley, B. J. (2015). Les cultures dérivées de cellules souches neurales humaines dans des substrats tridimensionnels forment des réseaux neuronaux spontanément fonctionnels. Journal d'ingénierie tissulaire et de médecine régénérative. DOI : 10.1002 / terme.2001.
- ↑ Harris, J., Tomassy, G. S. et Arlotta, P. (2015), Éléments constitutifs du cortex cérébral : du développement au plat. FILS Dev Biol. doi: 10.1002 / wdev.192
- ↑ Anca M Paşca, Steven A Sloan, Laura E Clarke, Yuan Tian, Christopher D Makinson, Nina Huber, Chul Hoon Kim, Jin-Young Park, Nancy A O'Rourke, Khoa D Nguyen, Stephen J Smith, John R Huguenard , Daniel H Geschwind, Ben A Barres, Sergiu P Paşca (2015). Neurones corticaux fonctionnels et astrocytes de cellules souches pluripotentes humaines en culture 3D. Méthodes naturelles ; DOI : 10.1038 / nmeth.3415
- ↑ Rene Anand (2015) Des scientifiques cultivent un cerveau fœtal humain dans une assiette de laboratoire à partir de cellules souches. Scicasts
- ↑ Jürgen Knoblich Comment construire un cerveau // Dans le monde de la science. - 2017. - N° 3. - P. 40 - 44.
- ↑ Stuart M. Chambers, Jason Tchieu, Lorenz Studer Build-a-Brain // Cellule souche cellulaire. - 2013-10-03. - T. 13, non. 4. - P. 377-378. - DOI : 10.1016 / j.stem.2013.09.010.
- ↑ Schwartza, M P., Houb, Z, Propson N E. et autres & Thomson JA (2015). Constructions neuronales dérivées de cellules souches pluripotentes humaines pour prédire la toxicité neuronale. Actes de l'Académie nationale des sciences, DOI : 10.1073/pnas.1516645112
- ↑ Nicholas C. Zachos, Olga Kovbasnjuk, Jennifer Foulke-Abel, Julie In, Sarah E. Blutt Entéroïdes Humains / Colonoïdes Et Organoïdes Intestinaux Récapituler Fonctionnellement La Physiologie Intestinale Normale Et La Physiopathologie // Journal of Biological Chemistry. - 2016-02-19. - Vol. 291, iss. 8. - P. 3759-3766. - ISSN 1083-351X 0021-9258, 1083-351X. -DOI : 10.1074 / jbc.r114.635995.
- ↑ Dyuzheva T.G., Lyundup A.V., Klabukov I.D., Chvalun S.N., Grigoriev T.E., Shepelev A.D., Tenchurin T.Kh., Krasheninnikov M.E., Oganesyan R .IN. Perspectives de création d'un canal cholédoque par génie tissulaire // Gènes et cellules. - 2016. - T. 11, n° 1. - S. 43-47. - ISSN 2313-1829.
- ↑ Mahe, M. M., Sundaram, N., Watson, C. L., Shroyer, N. F. et Helmrath, M. A. (2015). Établissement d'entéroides épithéliaux humains et de colonoïdes à partir de tissus entiers et de biopsie. Journal des expériences visualisées : JoVE, (97). 52483. DOI : 10.3791 / 52483
- ↑ Lukovac, S., & Roeselers, G.(2015). Les organoïdes de la crypte intestinale comme modèles expérimentaux. Dans L'impact des aliments bioactifs sur la santé (pp. 245-253). Éditions internationales Springer. DOI : 10.1007/978-3-319-16104-4_22
- ↑ van de Wetering, M., Francies, H. E., Francis, J. M., Bounova, G., Iorio, F., Pronk, A., ... & Clevers, H. (2015). Dérivation prospective d'une biobanque d'organoïdes vivants de patients atteints de cancer colorectal. Cellule, 161 (4), 933-945. EST CE QUE JE:
- ↑ Higgins C.A., Chen J.C., Cerise J.E. et al. & Christiano A. M. (2013) La reprogrammation microenvironnementale par culture tridimensionnelle permet aux cellules de la papille cutanée d'induire de novo la croissance des follicules pileux humains. PNAS, doi : 10.1073/pnas.1309970110
- ↑ Les bio-bots musculaires marchent sur commande (eng.), ScienceQuotidien... Consulté le 2 juillet 2017.
- ↑ Madden, L., Juhas, M., Kraus, W. E., Truskey, G. A. et Bursac, N. (2015). Les myobundles humains issus de la bio-ingénierie imitent les réponses cliniques du muscle squelettique aux médicaments. eLife. EST CE QUE JE:
- ↑ Morimoto, Y., Kato-Negishi, M., Onoe, H. et Takeuchi, S. (2013). Constructions neuro-musculaires tridimensionnelles avec jonctions neuromusculaires. Biomatériaux, 34 (37), 9413-9419.
- ↑ Mark Juhas, George C. Engelmayr, Jr., Andrew N. Fontanella, Gregory M. Palmer et Nenad Bursac (mars 2014). Muscle biomimétique conçu avec une capacité d'intégration vasculaire et de maturation fonctionnelle in vivo. PNAS, DOI : 10.1073/pnas.1402723111
- ↑ Kirill Stasevich (avril 2014). LES MUSCLES ARTIFICIELS SONT DISPONIBLES POUR L'AUTO-TRAITEMENT. COMPULENT
- ↑ Claudia Fuoco, Roberto Rizzi, Antonella Biondo, et al., (2015). n vivo génération d'un muscle squelettique artificiel mature et fonctionnel. EMBO Médecine moléculaire, DOI : 10.15252 / emmm.201404062
- ↑ Des ingénieurs cultivent des muscles humains fonctionnels à partir de cellules de la peau
- ↑ Ilario Fulco, Sylvie Miot, Martin D Haug, et al. (2014). Tissu cartilagineux autologue conçu pour la reconstruction nasale après résection tumorale : un premier essai d'observation chez l'homme. La Lancette. DOI : 10.1016 / S0140-6736 (14) 60544-4
- ↑ Atlántida M Raya-Rivera, Diego Esquiliano, Reyna Fierro-Pastrana, et al. & Anthony Atala (2014). Organes vaginaux autologues fabriqués par ingénierie tissulaire chez les patients: une étude de cohorte pilote. La Lancette ; DOI : 10.1016 / S0140-6736 (14) 60542-0
- ↑ Stasevich K. LE VAGIN D'UN TUBE À ESSAI A ÉTÉ SURVEILLÉ DANS L'ORGANISME HUMAIN. COMPULENT
- ↑ Jyothsna Vasudevan, Jyothsna Vasudevan. Oesophage humain créé à partir d'un échafaudage 3D infusé de cellules souches. Biotechin.Asia, 25 août 2015. Consulté le 2 juillet 2017.
- ↑ Zhili Rong, Meiyan Wang, Zheng Hu et al. &, Xuemei Fu. (2014) Une approche efficace pour prévenir le rejet immunitaire des allogreffes humaines dérivées de l'ESC. Cellule souche cellulaire; 14 (1) : 121 DOI : 10.1016 / j.stem.2013.11.014
- ↑ Plege-Fleck A, Lieke T, Römermann D, Düvel H, Hundrieser J, Buermann A, Kraus L, Klempnauer J, Schwinzer R. Greffe de cellules de porc à rat : réponses réduites et en anticorps aux xénogreffes surexprimant PD-L1. Xénotransplantation 2014 ; 21 : 533-542. DOI : 10.1111 / xen.12121
- ↑ La glande thyroïde, créée à l'aide de la bio-impression 3D, a été transplantée avec succès chez des souris (russe). Consulté le 2 juillet 2017.
- ↑ Elena A. Bulanova, Elizaveta V. Koudan, Jonathan Degosserie, Charlotte Heymans, Frederico DAS Pereira Bioprinting d'une construction fonctionnelle de glande thyroïde de souris vascularisée (Anglais) // Biofabrication. - 2017. - Vol. 9, iss. 3. - P. 034105. - ISSN 1758-5090. - DOI : 10.1088 / 1758-5090 / aa7fdd.
- ↑ Mosaïque, Moheb Costandi -... L'homme qui a fait pousser les yeux de zéro (eng.), Gizmodo... Consulté le 2 juillet 2017.
- ↑ Bement, W. M., & von Dassow, G. (2014). Formation de motifs cellulaires uniques et réseaux cytosquelettiques transitoires. Opinion actuelle en biologie cellulaire, 26, 51-59.
- ↑ Ishihara, K., Nguyen, P. A., Wühr, M., Groen, A. C., Field, C. M. et Mitchison, T. J. (2014). Organisation des premiers embryons de grenouilles par des ondes chimiques émanant des centrosomes. Transactions philosophiques de la Royal Society B: Sciences biologiques, 369 (1650), 20130454.
- ↑ Karus, M., Blaess, S. et Brüstle, O. (2014). Auto‐organisation des architectures tissulaires neuronales à partir de cellules souches pluripotentes. Journal de neurologie comparée.
- ↑ S.A. Zhivolupov, N.A. Rashidov, I.N. Samartsev, E.V. Yakovlev Idées modernes sur la régénération des fibres nerveuses dans les lésions du système nerveux périphérique // Bulletin de l'Académie de médecine militaire russe. - 2013. - N°3 (43). - S. 190-198. - ISSN 1682-7392.
- ↑ Greggio, C., De Franceschi, F. et Grapin-Botton, A. (2015), Concise Reviews: In Vitro-Produced Pancreas Organogenese Models in Three Dimensions: Self-Organization From Few Stem Cells or Progenitors. CELLULES SOUCHES, 33 : 8-14. DOI : 10.1002 / tige.1828
- ↑ Baranovskiy D.S., Demchenko A.G., Oganesyan R.V., Lebedev G.V., Berseneva D.A., Balyasin M.V., Parshin V.D., Lyundup A.V. Obtention d'une matrice acellulaire de cartilage trachéal pour les constructions d'ingénierie tissulaire (russe) // Bulletin de l'Académie russe des sciences médicales. - 2017 .-- T. 72, no. 4. - P. 254-260. - ISSN 2414-3545. -DOI : 10.15690/vramn723.
- ↑ Lyundup A.V., Demchenko A.G., Tenchurin T.Kh., Krasheninnikov M.E., Klabukov I.D., Shepelev A.D., Mamagulashvili V.G., Oganesyan R.V., Orekhov A S., Chvalun S.N., Dyuzheva T.G. Augmenter l'efficacité de la colonisation des matrices biodégradables par les cellules stromales et épithéliales lors de la culture dynamique // Gènes et cellules. - 2016. - T. 11, n° 3. - S. 102-107. - ISSN 2313-1829.
- ↑ L'équipe de MGH développe un membre antérieur transplantable par bio-ingénierie dans un modèle animal. Hôpital général du Massachusetts. Consulté le 2 juillet 2017.
- ↑ Sur un membre : des scientifiques pionniers font pousser des bras de singe en laboratoire. GTNO.11 août 2015. Consulté le 2 juillet 2017.
- ↑ Bernhard J. Jank, Linjie Xiong, Philipp T. Moser et al. & Harald C. Ott (2015). Tissu composite conçu comme greffe de membre bioartificiel. Biomatériaux, 61, 246-256 DOI : 10.1016 / j.biomatériaux.2015.04.051
- ↑ Muscle cardiaque fonctionnel régénéré dans des cœurs humains décellularisés. Consulté le 2 juillet 2017.
- ↑ Guyette JP, Charest JM, Mills RW, Jank BJ, Moser PT, Gilpin SE, Gershlak JR, Okamoto T, Gonzalez G, Milan DJ, Gaudette GR, Ott HC. (2015). Bio-ingénierie du myocarde humain sur matrice extracellulaire native. Circ Res.; 118 (1), 56-72. DOI : 10.1161 / CIRCRESAHA.115.306874 PMID 26503464
- ↑ Les médecins de Saint-Pétersbourg ont installé une prothèse de trachée de bio-ingénierie (russe). Consulté le 2 juillet 2017.
Littérature
- Des scientifiques russes ont créé un foie bio-artificiel. 3 septembre 2014, 14:39
- Andrey Konstantinov (2014). Coeur du bioréacteur "Russian Reporter" n° 19 (347)
- Victoria Sevostyanova (2014) Besoin d'une nouvelle aorte ? Cultivez-le vous-même !. SCIENCE ET VIE, 04
- Kirill Stasevitch (2015). Comment faire pousser un cerveau dans un tube à essai. SCIENCE ET VIE 6
- Kirill Stasevitch (2014). L'estomac humain a été cultivé dans un tube à essai. SCIENCE ET VIE 10
- Kondratenko Julia (2015). Les organes du laboratoire.
- Rupert Wingfield-Hayes (2014) Le Japon veut faire pousser des organes sur des porcs pour les gens de la BBC, Préfecture d'Ibaraki, Japon - Vidéo.
- Akkerman, N., & Defize, L. H. (2017). L'aube de l'ère organoïde. BioEssais. DOI: 10.1002 / bies.201600244 Article de synthèse pour une connaissance préliminaire des méthodes de culture des organites et de leurs problèmes
- Takebe, T., Enomura, M., Yoshizawa, E., Kimura, M., Koike, H., Ueno, Y., ... & Taniguchi, H. (2015). Bourgeons d'organes vascularisés et complexes de divers tissus via la condensation mésenchymateuse dirigée par les cellules. Cellule souche cellulaire, 16 (5), 556-565. EST CE QUE JE:
- Yin, X., Mead, B. E., Safaee, H., Langer, R., Karp, J. M. et Levy, O. (2016). Organoïdes de cellules souches d'ingénierie. Cellule souche cellulaire, 18 (1), 25-38. EST CE QUE JE:
- Yunying Liu, Ru Yang, Zuping He et Wei-Qiang Gao (2013) Génération d'organes fonctionnels à partir de cellules souches. Régénération cellulaire, 2: 1 doi: 10.1186/2045-9769-2-1
- Kelly Rae Chi (2015). Orchestrer les organoïdes. Un guide pour fabriquer des tissus dans un plat qui reprend des organes in vivo. Le scientifique.
- Manuel de culture. et l'utilisation d'organites (2016). Manuel de culture organoïde
- Kan Handa, Kentaro Matsubara, Ken Fukumitsu, Jorge Guzman-Lepe, Alicia Watson, Alejandro Soto-Gutierrez. Assemblage D'organes Humains De Cellules Souches Pour Étudier Les Maladies Du Foie // The American Journal of Pathology. - 2014. - Vol. 184, non. 2. - P. 348-357. - DOI : 10.1016 / 0092-8674 (83) 90040-5.
- Melissa A. Kinney, Tracy A. Hookway, Yun Wang, Todd C. McDevitt (décembre 2013) Ingénierie de la morphogenèse tridimensionnelle des cellules souches pour le développement de modèles tissulaires et de thérapies régénératives évolutives. Annales de génie biomédical. DOI : 10.1007 / s10439-013-0953-9
- Yeux cultivés en laboratoire - Vidéo "Comment les yeux d'un lapin vivant ont été cultivés".
- Hitomi Matsunari, Hiroshi Nagashima, Masahito Watanabe et al. et Hiromitsu Nakauchi (2013). La complémentation des blastocystes génère un pancréas exogène in vivo chez les porcs clonés pancréatiques. PNAS, 110 (12), 4557-4562, doi: 10.1073/pnas.1222902110
- Feng, W., Dai, Y., Mou, L., Cooper, D. K., Shi, D. et Cai, Z. (2015). Le potentiel de la combinaison de CRISPR / Cas9 et de cellules souches pluripotentes pour fournir des organes humains à partir de porcs chimériques. Journal international des sciences moléculaires, 16 (3), 6545-6556. DOI : 10.3390 / ijms16036545
- En tant que cœur vivant, le cœur battant est cultivé à partir de cellules souches. IL FAUT REGARDER LA VIDÉO
- Christa Nicole Grant, Garcia Mojica Salvador, Frederic G Sala et al. (2015). L'intestin grêle obtenu par génie tissulaire chez l'homme et la souris démontre une fonction digestive et une fonction d'absorption. American Journal of Physiology - Physiologie gastro-intestinale et hépatique, DOI: 10.1152 / ajpgi.00111.2014
- Donghui Zhang et Wei Jiang (2015). De la cellule unique au tissu : reprogrammation, différenciation cellulaire et ingénierie tissulaire. BioScience, doi: 10.1093/biosci/biv016
- Cassandra Willyard (2015). Le boom des mini-estomacs, cerveaux, seins, reins et plus encore. Nature 523, 520-522 DOI : 10.1038 / 523520a
- Télécharger le guide d'application : Organoïde (structures semblables à des organes pouvant être formées par culture cellulaire 3D) Croissance sur BME 2.
- Purwada, A., Jaiswal, M. K., Ahn, H., Nojima, T., Kitamura, D., Gaharwar, A. K., ... & Singh, A. (2015). Organoïdes immunitaires conçus ex vivo pour des réactions contrôlées du centre germinatif.Biomatériaux, 63, 24-34. DOI : 10.1016 / j.biomatériaux.2015.06.002
- Broutier, L., Andersson-Rolf, A., Hindley, C.J., Boj, S.F., Clevers, H., Koo, B.K., & Huch, M. (2016). Culture et établissement d'organoïdes 3D auto-renouvelables du foie et du pancréas adultes humains et souris et leur manipulation génétique. Protocoles de la nature, 11 (9), 1724-1743. DOI : 10.1038 / nprot.2016.097
- García-Domínguez, X., Vera-Donoso, C. D., García-Valero, L., Vicente, J. S. et Marco-Jimenez, F. (2016). Transplantation d'organes embryonnaires : la nouvelle ère de la xénotransplantation. Dans Frontières en transplantologie. InTech. DOI : 10.5772 / 62400
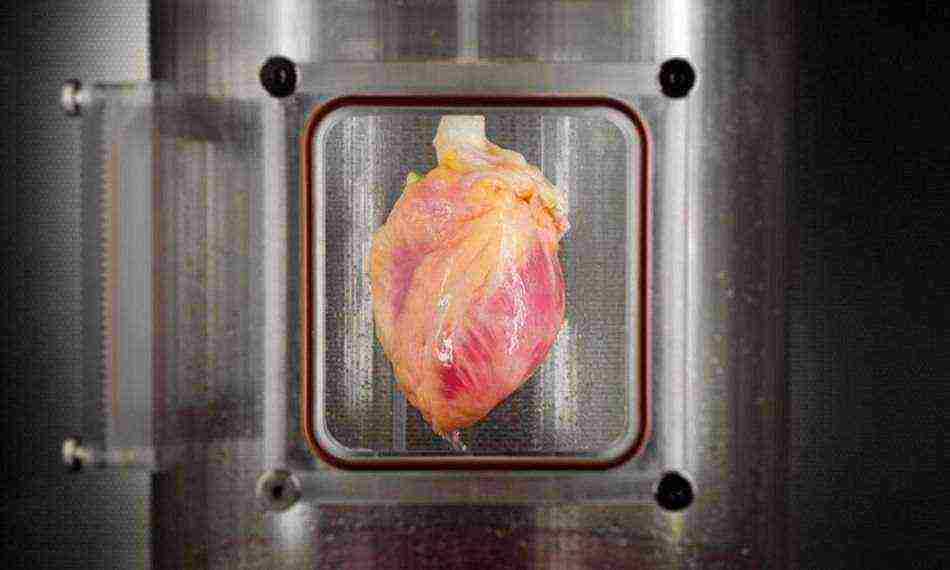
Des milliers de personnes dans le monde attendent des cœurs de donneurs qui peuvent leur sauver la vie. Mais seuls quelques-uns d'entre eux ont une telle chance, et étant donné que le corps peut rejeter l'organe de quelqu'un d'autre, cela réduit considérablement le nombre de greffes réussies. Les scientifiques travaillent depuis longtemps pour résoudre ce problème, et maintenant une équipe de chercheurs du Massachusetts Central Hospital, ainsi que des employés de la Harvard Medical School, sont sur le point de créer des cœurs cultivés artificiellement.
Des scientifiques américains ont cultivé du tissu cardiaque humain dans des conditions de laboratoire, comme le rapporte le journal. Pour les créer, les cellules de la peau d'un adulte ont été utilisées. Idéalement, tout cela devrait conduire à l'avenir à la culture de cœurs battants à part entière à partir des cellules de ces personnes qui ont besoin d'une greffe d'organe. Les organes sont beaucoup plus faciles à cultiver en laboratoire, où les scientifiques disposent d'une sorte d'échafaudage pour les futurs organes à travers lesquels les cellules sont distribuées.
Dans leurs travaux précédents, les scientifiques ont créé une technologie qui permet d'exclure la réponse immunitaire du corps du receveur lors de la transplantation d'un organe d'une autre personne. Ils ont réussi à y parvenir en éliminant certaines cellules potentiellement capables de provoquer une réponse immunitaire de l'organe donneur à l'aide d'une solution détergente. Les scientifiques ont repeuplé la matrice extracellulaire restante avec le type approprié de cellules compatibles avec le receveur. De cette façon, les scientifiques ont déjà réussi à créer des reins et des poumons pleinement fonctionnels pour des rats de laboratoire.
La prochaine étape des scientifiques consistait à expérimenter un vrai cœur humain dans un bioréacteur spécialement créé. L'organe a été nettoyé des cellules potentiellement dangereuses, après quoi l'échafaudage restant a été repeuplé avec des cellules cardiaques. Les expériences ont été menées sur 73 cœurs humains, qui ont été fournis aux chercheurs par l'une des banques d'organes. Ne vous inquiétez pas, ces cœurs étaient toujours déclarés impropres à la transplantation, ils ne pouvaient donc sauver la vie de personne.
Pour obtenir des cellules cardiaques, les chercheurs ont utilisé une nouvelle méthode. Ils ont reprogrammé les cellules cutanées adultes à l'aide de facteurs d'ARN messager, ce qui entraîne moins de difficultés dans la régulation ultérieure des processus. Les cellules souches pluripotentes résultantes ont été différenciées en cellules musculaires cardiaques. Les cellules obtenues étaient largement suffisantes pour la recherche et leur transplantation sur des échafaudages cardiaques. Déjà quelques jours plus tard, les scientifiques ont réussi à faire croître spontanément du tissu musculaire en contractant au-dessus du squelette.
Pour la première fois, des scientifiques ont réussi à régénérer le muscle cardiaque humain à partir de cellules souches pluripotentes dans la matrice acellulaire d'un cœur humain entier. Ils ont transplanté environ 500 millions de cellules dans la paroi du ventricule gauche d'un organe auparavant dépourvu de cellules cardiaques. Après cela, le cœur est resté dans le système de bioréacteur automatisé pendant deux semaines. Pendant ce temps, les scientifiques ont fourni au cœur une solution nutritive et ont agi avec divers facteurs de stress. En conséquence, les cellules ont été transformées en tissu cardiaque immature qui répond à la stimulation électrique.
Bien sûr, jusqu'à présent, il ne s'agit que d'expériences, mais il convient de noter que leurs résultats sont très prometteurs. À l'avenir, une telle technologie pourrait se transformer en une culture à part entière de cœurs humains in vitro, qui pourra donner une seconde chance aux personnes qui attendent depuis des années un organe donneur approprié.


